
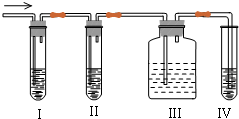
分析 二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键,能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,以此解答该题.
解答 解:二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键,能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,
(1)装置①中盛有品红溶液,用来检验二氧化硫的存在;然后将气体通入盛有氢氧化钠溶液的②除去二氧化硫,再通入盛有品红溶液的③确定二氧化硫是否除干净,最后通入盛有酸性高锰酸钾的④检验乙烯的存在;
故答案为:A;B;A;D;
(2)装置Ⅲ中的品红溶液不退色可以排除二氧化硫的干扰,若装置Ⅳ中的酸性KMnO4溶液退色,可证明乙烯的存在;
故答案为:装置Ⅲ中品红不褪色,装置Ⅳ中酸性 KMnO4溶液褪色.
点评 本题考查了乙烯的实验室制法以及产物的检验,侧重于学生的分析、实验能力的考查,为高频考点,熟悉二氧化硫、乙烯的性质是解题关键,注意实验设计的严密性,气体检验的顺序,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | A、B、C最简单氢化物的沸点依次递减,是因为A、B、C非金属性依次递减 | |
| B. | EB晶体是一种坚硬的高熔点材料,熔化时需克服离子键 | |
| C. | 在一定条件下,B的氧化物与B的简单氢化物均能反应生成单质B | |
| D. | C、D的常见氧化物均能溶于氢氧化钠溶液中,则C、D的氧化物均属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
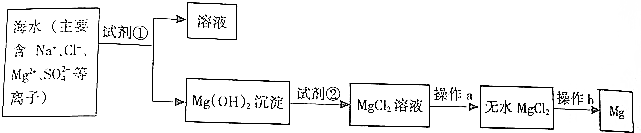
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
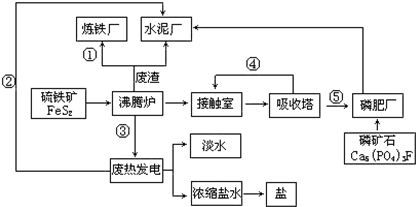
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12溶液.Na+、SO32一、ClO-、CO32- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Fe2+、Cl-、NO3- | |
| C. | 0.1mol/LBa (OH)2溶液中:Al3+、NH4+、NO3-、HCO3- | |
| D. | 0.1mol/L AlO2-溶液中:Na+、K+、SO32一、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴水中,测定反应前后溶液pH,pH增大,乙烯与溴发生取代反应 | |
| B. | 向某溶液中加入KSCN溶液和稀盐酸,溶液变红色,原溶液一定有Fe3+ | |
| C. | 将湿润的氨气通过无水CaCl2,可得到干燥的氨气 | |
| D. | 分别取一块小木条,放入饱和硅酸钠溶液和蒸馏水中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,前者木条未燃烧,后者燃烧,可证明硅酸钠可作木材防火剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com