
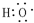 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.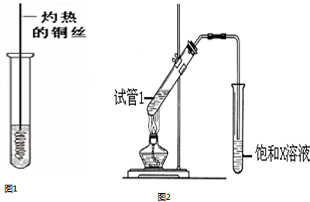
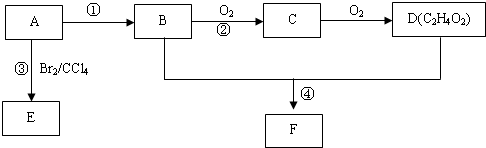
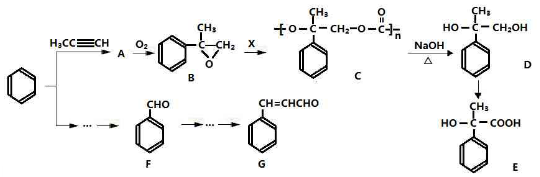
分析 A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结合D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成F为CH3COOCH2CH3,乙烯与溴发生加成反应生成E为1,2-二溴乙烷.
解答 解:A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结合D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成F为CH3COOCH2CH3,乙烯与溴发生加成反应生成E为1,2-二溴乙烷,
(1)A的结构简式为CH2=CH2,B中官能团的电子式为 ,D中官能团的名称为羧基,故答案为:CH2=CH2;
,D中官能团的名称为羧基,故答案为:CH2=CH2;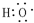 ;羧基;
;羧基;
(2)反应①的反应类型是加成反应,反应③为乙烯和溴的加成反应,该反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成;CH2=CH2+Br2→CH2BrCH2Br;
(3)加热铜丝时,Cu和氧气反应生成黑色的CuO,在加热条件下,CuO和乙醇发生氧化还原反应生成有刺激性气味的乙醛和Cu,所以看到的现象是铜丝由黑色变红色,产生刺激性气味,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:铜丝由黑色变红色,产生刺激性气味;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)D是乙酸,能和碳酸氢钠反应生成乙酸钠、二氧化碳和水,离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑,
故答案为:CH3COOH+HCO3-→CH3COO-+H2O+CO2↑;
(5)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,乙酸乙酯不易溶于水,饱和碳酸钠溶液能抑制乙酸乙酯溶解,且能吸收乙醇,能和乙酸反应生成可溶性的乙酸钠,所以X为Na2CO3,
浓硫酸作催化剂和吸水剂,生成乙酸乙酯的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2OCH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:Na2CO3;催化剂、吸水剂;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查有机物的推断,为高频考点,涉及烯、醇、醛、羧酸等的性质与转化等,根据A结合物质的性质利用顺推法进行判断,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
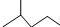 表示的分子式为C6H14;
表示的分子式为C6H14;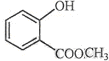 中含有的官能团的名称为羟基、酯基;
中含有的官能团的名称为羟基、酯基;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
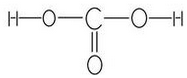 .
. .
.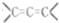 的有机物不能稳定存在)
的有机物不能稳定存在)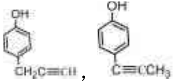 .
.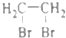
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
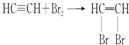
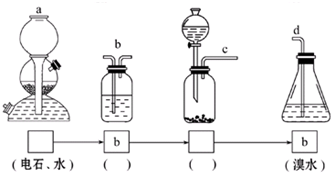
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不变 | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内生成2n mol的AB,同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
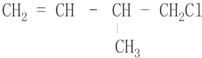
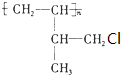 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com