氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察图1,回答:
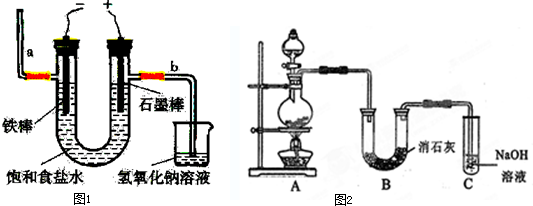
(1)若饱和食盐水中通电后b侧产生的气体通入NaOH溶液中所发生的反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(2)电解反应的化学方程式为
.
II.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是
2mol
2mol
.
(2)漂白粉将在U形管中产生,其化学方程式是
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
.
(3)C装置的作用是
吸收未反应完的氯气,防止污染空气
吸收未反应完的氯气,防止污染空气
.
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.
①温度较高时氯气与消石灰反应生成Ca(ClO
3)
2,为避免此副反应的发生,可采取的措施是
冷却B装置
冷却B装置
.
②试判断另一个副反应(用化学方程式表示)
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.为避免此副反应的发生,可将装置作何改进
在B、C之间连接一个盛有饱和食盐水的洗气瓶
在B、C之间连接一个盛有饱和食盐水的洗气瓶
.
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是
B
B
.
A.食盐 B.食醋 C.烧碱 D.纯碱.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案