
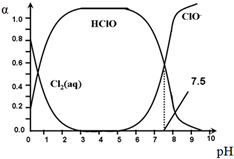
 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:| A. | Cl2(g)+H2O?2H++ClO-+Cl- K=10-10.9 | |
| B. | pH=7.5时,用氯处理饮用水体系中,c(Cl-)+c(HClO)=c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 | |
| D. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
分析 根据图象知,HClO?H++ClO-中pH=7.5,此时c(HClO)=c(ClO-),Ka=$\frac{c({H}^{+})•c(Cl{O}^{-})}{c(HClO)}$=$\frac{1{0}^{-7.5}×c(Cl{O}^{-})}{c(HClO)}$=10-7.5;
A.盖斯定律计算K;
B.任何电解质溶液中都存在电荷守恒;
C.HClO的杀菌能力比ClO-强,所以HClO的浓度越大,其杀菌效果越好;
D.HClO不稳定,受热易分解.
解答 解:根据图象知,HClO?H++ClO-中pH=7.5,Ka=$\frac{c({H}^{+})•c(Cl{O}^{-})}{c(HClO)}$=$\frac{1{0}^{-7.5}×c(Cl{O}^{-})}{c(HClO)}$=10-7.5;
A.依据盖斯定律将已知的三个式子相加可得A选项式,所以K=K1×K2×Ka=K1=10-1.2×10-3.4×10-7.5=10-12.1,故A错误;
B.体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),即c(Cl-)+c(ClO-)=c(H+)-c(OH-),pH=7.5时,根据图可知c(HClO)=c(ClO-),所以,c(Cl-)+c(HClO)=c(H+)-c(OH-),故B正确;
C.起杀菌作用的是HClO,由图象可知,pH=6.5时c(HClO)比pH=4.5时要小,HClO浓度越大,杀菌效果好,所以pH=4.5时杀菌效果比pH=6.5时好,故C错误;
D.夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,故D错误;
故选B.
点评 本题以氯水为载体考查了化学平衡常数的计算、离子浓度大小比较、物质的稳定性等知识点,正确分析图象中各个物理量的关系是解本题关键,再结合盖斯定律、物质的性质等知识点来分析解答,题目难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
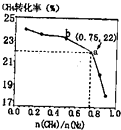 CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )| A. | $\frac{n(C{H}_{4})}{n({N}_{2})}$越大,CH4的转化率越高 | |
| B. | $\frac{n(C{H}_{4})}{n({N}_{2})}$与不变时,升温,NH3的体积分数会减小 | |
| C. | b点对应的平衡常数比a点的大 | |
| D. | a点对应的NH3的体积分数约为13% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2A1O2-+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com