
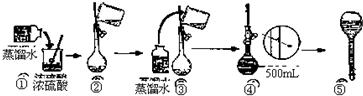
分析 Ⅰ.(1)根据浓硫酸在稀释前后,溶质的物质的量保持不变;(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=$\frac{n}{V}$,可以根据影响n和V的因素来分析回答;
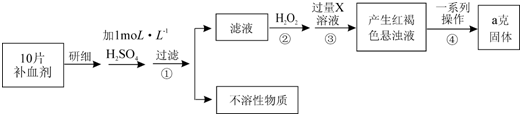
Ⅱ.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(2)三价铁离子与氢氧根反应生成氢氧化铁沉淀;
(3)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(4)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算;
Ⅲ.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收.
解答 解:Ⅰ.(1)浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10-3×1mol/L=18.4mol/L×V,解得V=5.4mL,故答案为:5.4 mL;
(2)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,故答案为:A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,故答案为:①④;
(4)A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确;
B.未冷却体积偏小,浓度偏大,故B错误;
C.定容时仰视,体积偏大,浓度偏小,故C正确;
D.在瓶中放水到标线附近,塞紧瓶塞,使其倒立2min,用干滤纸片沿瓶口缝处检查,看有无水珠渗出.如果不漏,再把塞子旋转180°,塞紧,倒置,试验这个方向有无渗漏,故D错误.
故答案为:AC;
Ⅱ.(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:把亚铁离子全部氧化成铁离子;
(2)三价铁离子与氢氧根反应生成氢氧化铁沉淀,离子方程式为:Fe3++3OH-=Fe(OH)3↓,故答案为:Fe3++3OH-=Fe(OH)3↓;
(3)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;
(4)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$=0.07ag,含硫酸亚铁的质量为$\frac{\frac{0.07ag}{56}}{152}$=0.19ag,故答案为:0.19ag;
Ⅲ.维生素C有还原性,能服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收,故答案为:作还原剂;防止Fe2+被氧化.
点评 本题考查学生对物质的量浓度溶液的配制实验原理与实验操作的理解、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
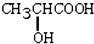 .问:
.问: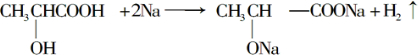
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
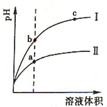 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度大于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向待测液里加入NaOH溶液,产生红褐色沉淀,则待测液中肯定含有Fe3+ | |
| B. | 向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42- | |
| C. | 向待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl- | |
| D. | 向待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,该气体通入澄清石灰水中,溶液变浑浊,则表明待测液中肯定含HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入NaOH溶液中 Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 硫化亚铁与稀硫酸反应 FeS+2H+═Fe2++H2S↑ | |
| C. | 硫酸铵和氢氧化钡溶液 Ba2++SO42-═BaSO4↓ | |
| D. | 氢氧化钡与稀硫酸反应 Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com