
| A. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,H2是负极 |
分析 氢镍电池的总反应式是$\frac{1}{2}$H2+NiO(OH)$?_{充电}^{放电}$ Ni(OH)2,反应中H元素化合价降低,为负极反应,负极反应为:H2-2e-+2OH-=2H2O,Ni元素化合价升高,被含还原,为正极反应,电极方程式为NiO(OH)+H2O+e-=OH-+Ni(OH)2,充电时的电极反应为放电时的逆反应,以此解答该题.
解答 解:A.电池放电时,负极反应式为:H2-2e-+2OH-=2H2O,所以电池周围溶液的氢氧根离子减少,溶液的PH值减小,故A错误;
B.电池放电时,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,镍元素被还原,故B错误;
C.充电时,阴极反应为,2H2O+2e-=H2+2OH-,氢元素被还原,故C错误;
D.电池放电时,负极反应为H2-2e-+2OH-=2H2O,H2是负极,故D正确.
共选D.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生的分析能力,题目难度不大,注意电极反应式的书写,根据电极反应判断溶液离子浓度的变化.


科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: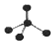 | B. | 乙酸的化学式:C2H4O2 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | F-的结构示意图: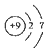 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | C 既是氧化剂又是还原剂 | |
| D. | 若生成4.48L CO,则转移0.4 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上利用铝热反应炼铁 | |
| B. | 将Mg、Al用导线连接并插入NaOH溶液中,判断Mg、Al金属性强弱 | |
| C. | 将CO2、SO2分别通入Ba(NO3)2溶液中,前者无明显现象,后者产生白色沉淀 | |
| D. | 实验室利用锌片和稀硫酸制H2时,为了加快制H2的反应速率可加入Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
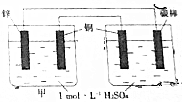
| A. | 乙池中铜电极反应是4OH--4e-═O2↑+2H2O | |
| B. | 甲池中的铜电极反应是2H++2e-═H2↑ | |
| C. | 碳棒上开始H+放电,然后是Cu2+放电 | |
| D. | 反应一段时间后甲乙两池溶液中H+的离子浓度不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com