
| A. | 51.2% | B. | 36.8% | C. | 41.5% | D. | 无法计算 |
分析 根据Na2S、Na2SO3和Na2SO4的混合物中钠原子与S原子个数比为2:1,可以找出混合物中Na原子与S原子的质量之比,据此计算出钠的质量分数,最后利用1-ω(Na)-ω(S)计算出氧的质量分数即可.
解答 解:Na2S、Na2SO3和Na2SO4中,Na与S原子个数比为2:1,二者物质的量之比为2:1,所以Na与S的质量比为:(23×2):32=23:16,
经测定此混合物中硫的质量分数为24%,所以钠的质量分数为:24%×$\frac{23}{16}$=34.5%,
混合物中氧元素的质量分数为:1-ω(Na)-ω(S)=1-24%-34.5%=41.5%,
故选C.
点评 本题考查质混合物的计算,题目难度不大,根据化学式明确Na、S元素质量之比为定值为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: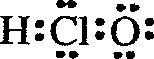 | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| B. | 在恒容密闭容器中充入一定量NO2建立2NO2(g)═N2O4(g)△H<0 平衡后,升高温度,体系颜色加深 | |
| C. | 向水中投入金属Na,最终溶液呈碱性 | |
| D. | FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫代硫酸钠溶液与稀硫酸反应:2S2O32-+4H+═3S↓+SO42-+2H2O | |
| B. | 在K2Cr2O7的溶液中:Cr2O72-+H2O?2 CrO42-+2H+ | |
| C. | 在KI的溶液滴加稀硫酸:4I-+4H++O2═I2+2H2O | |
| D. | 少量的铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com