
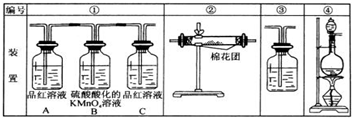
分析 (1)加热条件下,木炭和浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验;
(3)A的作用是检验二氧化硫、B的作用是除去二氧化硫、C的作用是检验二氧化硫是否存在;
(4)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气.
解答 解:(1)加热条件下,木炭和浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验,所以其连接顺序是④→②→①→③,
故答案为:④;②;①;③;
(3)实验时可观察到装置①中A瓶的溶液褪色c瓶的溶液不褪色,说明通过c瓶后气体中不含二氧化硫,
A的作用是检验二氧化硫,利用品红溶液褪色检验二氧化硫;
二氧化硫具有还原性、酸性高锰酸钾具有强氧化性,也可用强氧化剂过氧化氢或者溴水或者氯水来代替,二者发生氧化还原反应而使酸性高锰酸钾溶液褪色,所以B的作用是除去二氧化硫;
C的作用是检验二氧化硫是否存在,防止干扰二氧化碳检验,
故答案为:检验二氧化硫;除去二氧化硫;过氧化氢或者溴水或者氯水;检验二氧化硫是否除尽;
(4)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气,所以装置②中所装的固体药品是无水硫酸铜,也验证的产物是水,若在1、3后则无法检验水是否是生成物,故答案为:无水硫酸铜;H2O;若在1、3后则无法检验水是否是生成物.
点评 本题以浓硫酸为载体考查性质实验方案设计,明确实验原理是解本题关键,知道物质检验先后顺序及检验试剂的选取方法,难点是实验装置排列顺序,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
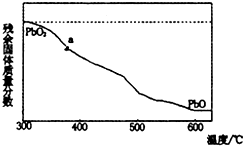 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:
四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、SO32-、MnO4- | |
| B. | pH=7的溶液中:Na+、Al3+、Cl-、SO42- | |
| C. | pH>12的溶液中:Na+、K+、SO42-、AlO2- | |
| D. | pH=0的溶液中:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “低碳”意指更低的二氧化碳气体的排放 | |
| B. | 太阳能、水能、风能都属于可再生能源 | |
| C. | 太阳能电池的工作原理是光能与化学能的转换 | |
| D. | 利用燃气轮机进行天然气发电不属于可再生能源利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com