
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |

分析 (1)从浓硫酸溶于水放热和加热时试管内液体的体积不超过试管容积的1/3分析,实验室用乙醇和乙酸在浓硫酸作用下加热生成乙酸乙酯;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(3)乙醇、乙酸的沸点较低,易挥发;
(4)根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析;
(5)从该装置与传统制备装置的使用的仪器的不同进行分析.
解答 解:(1)乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的1/3,加入药品的顺序为在一个30mL大试管中注入4mL乙醇,再分别缓缓加入4mL乙酸、1mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10mL);乙酸和乙醇发生的反应为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:在一个30 mL大试管中注入4 mL乙醇,再分别缓缓加入4 mL 乙酸、1 mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,易于分离,
故答案为:BC;
(3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应,所以为防止乙醇、乙酸挥发,造成原料的损失,应小火加热,
故答案为:因为反应物乙醇、乙酸的沸点较低,若用大火加热,反应物大量随产物蒸发而损失原料,温度过高可能发生其它副反应;
(4)碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,有香味,振荡时乙酸和碳酸钠反应而使溶液红色变浅,
故答案为:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)从该装置与传统制备装置的使用的仪器的不同进行分析,增加了温度计,有利于控制发生装置中反应液的温度,根据反应的可逆性特点,增加反应物有利于平衡向正方向移动,提高乙酸乙酯的产量,增加了冷凝装置,有利于收集产物,
故答案为:增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量,或增加了冷凝装置,有利于收集产物乙酸乙酯.
点评 本题主要考查了乙酸乙酯的制备,掌握乙酸乙酯的制备原理,以及运用原理理解实验装置的改进创新思路是解答的关键,题目难度中等.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上合成氨的原理 | |
| B. | 工业上产生硫酸 | |
| C. | 热的纯碱溶液洗涤效果更好 | |
| D. | 受热时,试管底部的NH4Cl部分转移至试管上端 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
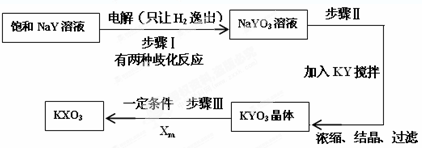
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 |
| K | 0.6 | 0.9 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
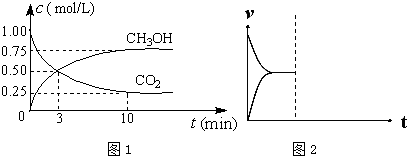
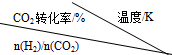 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水反应可能有O2生成 | |
| B. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| C. | 探究NO2被NaOH溶液吸收可能生成NaNO3 | |
| D. | 探究FeCl3与KI溶液的反应可能是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯水中通入二氧化硫,氯水的漂白性增强 | |
| B. | 氯水中加入NaCl固体,对溶液的pH无影响 | |
| C. | 常温下,pH=2的氯水中:c (Cl-)+c ( ClO-)+c (OH -)=0.01mol•L-1 | |
| D. | 向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-═2CO2↑+Cl -+ClO -+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳元素的单质只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.001 mol/L和0.10 mol/L 的HNO2溶液,分别用pH计测它们的pH,两者的pH相差小于2个单位 | |
| B. | 常温下90mL0.1 mol•L-1 HNO2溶液导电性比10mL0.1 mol•L-1 HCl溶液弱 | |
| C. | 10mL0.1 mol•L-1的HNO2与0.1 mol•L-1的NaOH恰好完全反应时,消耗10mLNaOH | |
| D. | 浓度相同的 HNO2溶液与NaNO2溶液中,后者NO2-浓度大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com