
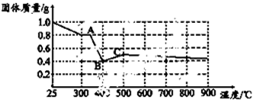
 某课题组为探究淡黄色草酸亚铁晶体(FeC2O4?2H2O)的化学性质,进行了一系列实验探究.
某课题组为探究淡黄色草酸亚铁晶体(FeC2O4?2H2O)的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
取少量黑色固体, |
| ||
| ||
| ||
| ||
| ||


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D | 元素的主族序数与周期数的差为3 |
| E | 元素是该周期电负性最大的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ |
| B、PO43- |
| C、CO32- |
| D、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,33.6 L SO3中含有的氧原子数是4.5NA |
| B、1 mol OH-和1 mol-OH(羟基)中含有的电子数均为9NA |
| C、在加热条件下,100 mL18.4 mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92 NA |
| D、当0.2 mol Na218O2与足量CO2完全反应后,生成碳酸钠的质量为21.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | SO2(mol) | O2(mol) | SO3 (mol) | He(mol) | △H(kJ?mol-1) |
| 1 | 2 | 1 | 0 | 0 | △H1 |
| 2 | 1 | 0.5 | 0 | 0 | △H2 |
| 3 | 1 | 0.5 | 0 | 1 | △H3 |
| 4 | 1 | 0.6 | 0 | 0 | △H4 |
| 5 | 0 | 0 | 2 | 0 | △H5 |
| A、△H1=2△H2 |
| B、△H3<△H4 |
| C、△H1+△H5=197 |
| D、△H2=△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| KW/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
| 纯水 | 加少量盐酸 | 加少量NaOH | |
| c(H+) | 1.0×10-7 mol/L | 增大 | |
| c(OH-) | 1.0×10-7 mol/L | 增大 | |
| c(H+)和c(OH-)大小比较 | c(H+)=c(OH-) | c(H+) | c(H+) |
| 水的电离平衡移动方向 | |||
| KW值 | 1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com