
| 1.56g |
| 78g/mol |
| 0.06mol |
| 0.12L |
| 0.06mol |
| 0.12L |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
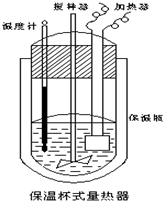 在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.
在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.查看答案和解析>>
科目:高中化学 来源: 题型:
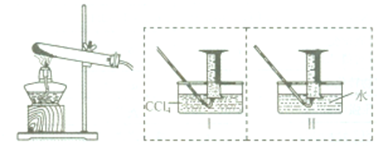
 如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:
如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3既能溶于NaOH溶液又能溶于HCl,说明Al2O3是两性氧化物 |
| B、浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、石英的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若A、B为同一周期元素,则AB3分子一定为平面正三角形 |
| B、若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形 |
| C、若为A、B为同一主族元素,则AB3分子一定为三角锥形 |
| D、若AB3分子为三角锥形,则AB3分子一定为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A、Al2H6中Al为-3价,H为+l价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6是共价化合物 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: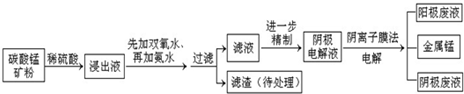
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com