
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
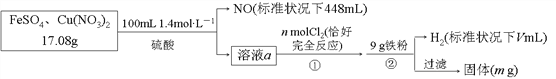
下列叙述中不正确的是( )
A. n=0.02 B. m=3.2
C. V=2240 D. 原混合物中FeSO4的质量分数约为89%
【答案】B
【解析】步骤②加入9g铁粉生成氢气,说明前面步骤硫酸有剩余,溶液a与nmol氯气完全反应,说明溶液a中含有Fe2+,17.08g FeSO4和Cu(NO3)2的混合物与0.14mol硫酸混合,NO3-全部被还原为NO,NO的物质的量是![]() ,根据氮元素守恒,样品中Cu(NO3)2的质量是
,根据氮元素守恒,样品中Cu(NO3)2的质量是![]() ,FeSO4的质量为17.08-1.88=15.2g; 物质的量是0.1mol;
,FeSO4的质量为17.08-1.88=15.2g; 物质的量是0.1mol;
设与硝酸根离子反应的亚铁离子的物质的量是xmol,消耗氢离子的物质的量为ymol;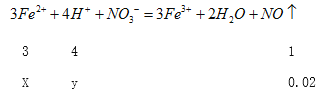
X =0.06,y=0.08mol;
溶液a中亚铁离子的物质的量是0.1-0.06=0.04mol;根据方程式![]() ,需要氯气0.02mol,故A正确;根据铁元素守恒,通入氯气后溶液中铁离子的物质的量是0.1mol,根据反应
,需要氯气0.02mol,故A正确;根据铁元素守恒,通入氯气后溶液中铁离子的物质的量是0.1mol,根据反应![]() ,消耗铁的物质的量是0.05mol,即2.8g;溶液a中氢离子的物质的量0.14
,消耗铁的物质的量是0.05mol,即2.8g;溶液a中氢离子的物质的量0.14![]() -0.08=0.2mol,根据
-0.08=0.2mol,根据![]() ,消耗铁0.1mol,即5.6g;a溶液中含有0.01mol
,消耗铁0.1mol,即5.6g;a溶液中含有0.01mol![]() ,消耗铁0.01mol,即0.56g;同时生成铜0.64g,剩余固体质量是9-2.8-5.6-0.56+0.64=0.68g,故B错误;生成氢气0.1mol,体积为2.24L,故C正确;原混合物中FeSO4的质量分数约为
,消耗铁0.01mol,即0.56g;同时生成铜0.64g,剩余固体质量是9-2.8-5.6-0.56+0.64=0.68g,故B错误;生成氢气0.1mol,体积为2.24L,故C正确;原混合物中FeSO4的质量分数约为![]() ,故D正确。
,故D正确。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A. Cu在加热时溶于过量浓硫酸:Cu+4H++![]()
![]() Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O
B. Na2O2与H2O反应制备O2:2Na2O2+2H2O=4Na++4OH-+O2↑
C. 向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++4OH-+2![]() =Mg(OH)2↓+2H2O+2
=Mg(OH)2↓+2H2O+2![]()
D. 向FeI2溶液中加入过量溴水:2Fe2++4I-+3Br2=2Fe3++2I2+6Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2 并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2 中可能混有杂质,其化学式为______和_________,原因是________。
(2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究。
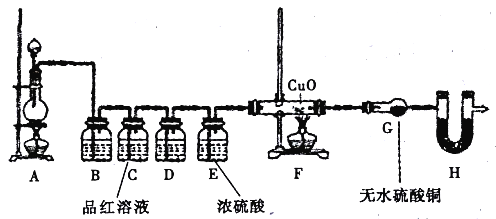
①为验证并吸收SO2,装置B 中加入的试剂为_____装置C中品红溶液的作用是_______;
②装置D中加入的试剂为____________;
③装置G中可能出现的现象为____________;
④装置H的作用为____________。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
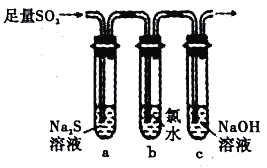
①能验证SO2 具有氧化性的实验现象为____________;
②为验证SO2 的还原性,取试管b 中充分反应后的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3 溶液,有白色沉淀生成
上述方案中合理的是____________(填“I”“ Ⅱ”或“Ⅲ”);试管b 中发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择_________盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42-已沉淀完全的方法是_________。
(3)操作③的离子方程式为_________。
(4)操作④的目的是_________。
(5)实验室进行操作⑤的具体步骤是_________。
(6)某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________。
②下列操作会使所配氯化钠溶液浓度偏小的是_________(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
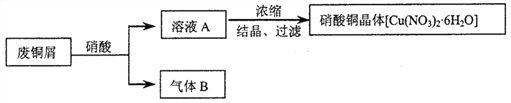
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含砷(As )的有毒工业废水经如下图流程转化为粗Aa2O3。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
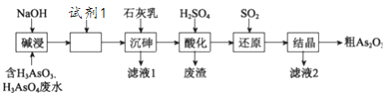
(1)加入试剂1的目的是:_________________________。
(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH 沉淀,发生的主要反应有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃, 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。
(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
(4)通过对H3AsO3溶液进行_____(填操作名称),再过滤可制得粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如下图所示。为控制滤液2 中As2O3的浓度不高于6×10-5 mol·L-1 ,则“结晶”过程应控制的条件是______________________(例举一例回答)
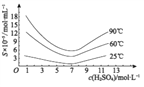
(5)从绿色化学和综合利用的角度考虑,对滤液2 处理方法是:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com