
| ||

| ||
| ||


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
| A、用NH4Cl溶液蒸干制备NH4Cl固体 |
| B、用重结晶法除去KNO3中混有的NaCl |
| C、用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
| D、用NaOH溶液和分液漏斗萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑥⑦⑧ | B、②⑤⑥⑦ |
| C、①③⑥⑦⑧ | D、②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)写出实验室用二氧化锰和浓盐酸反应制取氯气的离子方程式
(1)写出实验室用二氧化锰和浓盐酸反应制取氯气的离子方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Ag+)≠c(Cl-),c(Ag+)?c(Cl-)≠Ksp(AgCl) |
| B、c(Ag+)≠c(Cl-),c(Ag+)?c(Cl-)=Ksp(AgCl) |
| C、c(Ag+)=c(Cl-),c(Ag+)?c(Cl-)≠Ksp(AgCl) |
| D、c(Ag+)=c(Cl-),c(Ag+)?c(Cl-)=Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、涤纶、纤维素、酚醛树脂都是合成材料 |
| B、汽油和植物油都是混合物,主要成份是烃和酯 |
| C、甲酸与乙酸是有机酸,都不能被酸性高锰酸钾溶液氧化 |
| D、葡萄糖、蔗糖、淀粉在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
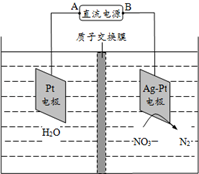 化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示:
化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com