
【题目】氨、烧碱在工农业生产和工业废水处理中具有广泛用途。回答下列问题:
(1)工业上制取硝酸的第一步是以氨和空气为原料,用铂一铑合金网为催化剂,在氧化炉中(温度为800℃)进行氨催化氧化反应。该反应的氧化产物为____________(填名称)。
(2)某工业废水中含有2Mg2+、Cu2+等离子。取一定量的该工业废水,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() 为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
(3)已知反应N2(g)+3H2(g)![]() 2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
(4)Fritz Haber 研究了下列反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:
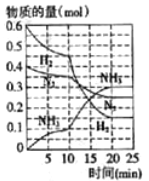
①在0~10min内,平均反应速率v(NH3)= ___________。
②在10~20min内,各物质浓度变化的原因可能是_________(填“加了催化剂”或“降低温度”),其判断理由是________________。
③温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,反应是否达到了化学平衡状态?___________(填“是”或“否”)其判断理由是_________________。
④500℃时,该反应的平衡常数K的计算式为_________(不需要算出结果,) NH3的体积分数是_________(保留两位小数)。
【答案】
(1)一氧化氮;(2)1.2×10-9;(3)1172.4;
(4)①0.005mol/(L·min);②加了催化剂;③是;合成氨的反应是气体分子数减少的反应,当容积一定时,总压强不再变化;④![]() ;0.46。
;0.46。
【解析】
试题分析:(1)氨和空气中的氧气反应生成一氧化氮和水,反应中N元素的化合价由-3价变成+2价,因此氧化产物为NO,故答案为:NO;
(2)某工业废水中含有Mg2+、Cu2+等离子,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() =
=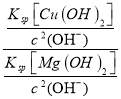 =
=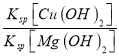 =
=![]() = 1.2×10-9,故答案为:1.2×10-9;
= 1.2×10-9,故答案为:1.2×10-9;
(3)设1mol NH3(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-944.6kJ-436kJ×3=92.2kJ,解得x=1172.4,故答案为:1172.4;
(4)①根据反应速率v(NH3)=![]() =
= =0.005mol/(L.min),故答案为:0.005mol/(L.min);②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2) = 0.025mol × 4=0.1mol ,△n(H2) = 0.025mol × 12 = 0.3mol ,△n(NH3) = 0.025mol × 8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,故答案为:加了催化剂;三种气体物质的速率增加倍数相同;
=0.005mol/(L.min),故答案为:0.005mol/(L.min);②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2) = 0.025mol × 4=0.1mol ,△n(H2) = 0.025mol × 12 = 0.3mol ,△n(NH3) = 0.025mol × 8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,故答案为:加了催化剂;三种气体物质的速率增加倍数相同;
③该反应属于气体的物质的量变化的反应,温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,说明反应达到了化学平衡状态,故答案为:是;合成氨的反应是气体分子数减少的反应,当容积一定时,总压强不再变化;
④化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,由图象可知,20min达平衡时,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以所以其平衡常数K=![]() =
=![]() ;第2次平衡时NH3的体积分数=
;第2次平衡时NH3的体积分数=![]() ×100%=45.5%,故答案为:
×100%=45.5%,故答案为:![]() ;0.46。
;0.46。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,11.2L苯中含有C﹣H键的数目为3NA
B.常温下,1.0LpH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1NA
C.常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
D.电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 制普通玻璃的主要原料是烧碱、石灰石、石英
B. SiO2是光导纤维的主要成分,晶体硅可用于制作半导体材料
C. 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液
D. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一组结构或物质的元素组成很可能是不相同的
A. 细菌体内的DNA与细胞膜
B. 蓝藻细胞内的拟核与玉米的细胞壁
C. 骨骼肌细胞内的线粒体与染色体
D. 植物细胞的细胞壁与动物细胞中的糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2;②Cl2;③CH4;④HCl;⑤NH3;⑥NO;⑦NO2;⑧SO2,下列操作正确的是
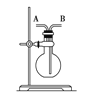
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老北京传统小吃历史悠久,是北京独树一帜的文化符号,门钉肉饼是其中之一。制作门钉肉饼的部分原料如下:①牛肉②面粉③盐④花生油。请回答:
(1)富含油脂的是______(填序号,下同)。
(2)富含淀粉的是______。
(3)富含蛋白质的是______。
(4)属于调味剂的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:
工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 ,生成5molClO2转移电子 mol。
方法二:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
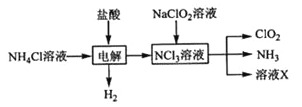
NCl3溶液和NaClO2溶液发生反应的离子方程式 。
X中大量存在的阴离子有_____ 。
(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
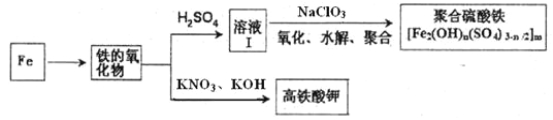
①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写出其氧化Fe2+的离子方程式: 。
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
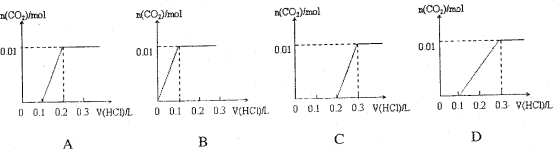
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com