
ҰңМвДүҰүСРңүМәә°Жд»ҮғПОпµДПа»ӨЧҒ»Ү¶ФДЬФөµДід·ЦАыУГҰұµНМәңәГУРЧЕЦШТҒµДЧчУГҰӘ
ӘЁ1Ә©ТСЦҒ:ұЩCH4(g)+H2O(g) ![]() CO(g)+3H2(g) ҰчH1=+206.1kJҰ¤mol-1
CO(g)+3H2(g) ҰчH1=+206.1kJҰ¤mol-1
ұЪ2H2(g)+CO(g) ![]() CH3OH(l) ҰчH2=-128.3kJҰ¤mol-1
CH3OH(l) ҰчH2=-128.3kJҰ¤mol-1
ұЫ2H2(g)+O2(g) ![]() 2H2O(g) ҰчH3=-483.6kJҰ¤mol-1
2H2O(g) ҰчH3=-483.6kJҰ¤mol-1
25ҰжК±,ФЪғПККµДөЯ»ҮәБЧчУГПВ,ІЙУГәЧНйғНСхЖшТ»ІҢғПіЙТғМ¬әЧөәµДИИ»ҮС§·ҢіМКҢОҒ_________ҰӘ
ӘЁ2Ә©АыУГ·өУ¦ұЩАөЦЖ±ёЗвЖш,ОҒБЛМҢңүОВ¶ИҰұС№Зү¶Ф·өУ¦ұЩЛЩВКҰұЧҒ»ҮВКµДУ°Пм,ДіН¬С§ЙиәЖБЛТФПВИэЧй¶Ф±ИКµСй(ОВ¶ИОҒ400Ұж»т500Ұж,С№ЗүОҒ101kPa»т404kPa)ҰӘ
КµСйРтғЕ | ОВ¶ИҰж | С№Зү/kPa | CH4іхКәЕЁ¶И/molҰ¤L-1 | H2OіхКәЕЁ¶И/molҰ¤L-1 |
1 | 400 | P | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
ұЩКµСй2ғНКµСй3Па±И,ЖдЖҢғвіӘКэ№ШПµКЗK2______K3(МоҰ°>Ұ±ҰұҰ°<Ұ±»тҰ°=Ұ±)ҰӘ
ұЪҢ«µИОпЦКµДБүµДCH4ғНЛ®ХфЖшідИл1LғгИЭГЬ±ХИЭЖчЦР,·ұЙъЙПКц·өУ¦,ФЪ400ҰжПВөпµҢЖҢғв,ЖҢғвіӘКэK=27,өЛК±ИЭЖчЦРCOОпЦКµДБүОҒ0.10mol,ФтCH4µДЧҒ»ҮВКОҒ________ҰӘ
ӘЁ3Ә©үЖС§әТМбіцУЙCO2ЦЖИҰCµДМ«СфДЬ№¤ТХИзНә1ЛщКңҰӘ
ұЩҰ°ЦШХыПµНіҰ±·ұЙъµД·өУ¦ЦРn(FeO):n(CO2)=6:1,ФтFexOyµД»ҮС§КҢОҒ______________ҰӘ
ұЪҰ°ИИ·ЦҢвПµНіҰ±ЦРГү·ЦҢвlmolFexOy,ЧҒТЖµзЧУµДОпЦКµДБүОҒ________ҰӘ

ӘЁ4Ә©pCАаЛЖpH,КЗЦёә«ПҰИЬТғЦРµДИЬЦКЕЁ¶ИµДіӘУГёғ¶ФКэЦµҰӘИфДіИЬТғЦРИЬЦКµДЕЁ¶ИОҒ1ҰБ10-3molҰ¤L-1,ФтёГИЬТғЦРИЬЦКµДpC=-lg(1ҰБ10-3)=3ҰӘИзНә2ОҒ25ҰжК±H2CO3ИЬТғµДpC-pHНәҰӘЗл»ШөрПВБРОКМв(ИфАлЧУЕЁ¶ИРҰУЪ10-5mol/L,үЙИПОҒёГАлЧУІ»өжФЪ):
ұЩФЪН¬Т»ИЬТғЦР,H2CO3ҰұHCO3-ҰұCO32-_____________(МоҰ°ДЬҰ±»тҰ°І»ДЬҰ±)өуБү№ІөжҰӘ
ұЪЗуH2CO3Т»ә¶µзАлЖҢғвіӘКэµДКэЦµKa1=________________ҰӘ
ұЫИЛМеСҒТғАпЦчТҒНЁ№эМәЛбЗвСО»ғіеМеПµc(H2CO3)/c(HCO3-)үЙТФµЦПыЙЩБүЛб»тәо,О¬іЦpH=7.4ҰӘµ±№эБүµДЛбҢшИлСҒТғЦРК±,СҒТғ»ғіеМеПµЦРµДc(H+)/c(H2CO3)ЧоЦХҢ«_______ҰӘ
A.±дөу B.±дРҰ C.»щ±ңІ»±д D.ОЮ·ЁЕР¶П
Ұңөр°ёҰү CH4(g)+1/2O2(g) ![]() CH3OH(l) ¦¤H1=-164.0kJ/mol > 10/11(90.0%Ұұ90.91%Ұұ10/11ҰБ100%) Fe3O4 2mol І»ДЬ 1ҰБ10-6 A
CH3OH(l) ¦¤H1=-164.0kJ/mol > 10/11(90.0%Ұұ90.91%Ұұ10/11ҰБ100%) Fe3O4 2mol І»ДЬ 1ҰБ10-6 A
ҰңҢвОцҰүӘЁ1Ә©ТСЦҒ:ұЩCH4(g)+H2O(g) ![]() CO(g)+3H2(g) ҰчH1=+206.1kJҰ¤mol-1
CO(g)+3H2(g) ҰчH1=+206.1kJҰ¤mol-1
ұЪ2H2(g)+CO(g) ![]() CH3OH(l) ҰчH2=-128.3kJҰ¤mol-1
CH3OH(l) ҰчH2=-128.3kJҰ¤mol-1
ұЫ2H2(g)+O2(g) ![]() 2H2O(g) ҰчH3=-483.6kJҰ¤mol-1
2H2O(g) ҰчH3=-483.6kJҰ¤mol-1
ёщңЭёЗЛ№¶ЁВЙӘ¬УЙұЩ+ұЪ+![]() ҰБұЫµГӘғCH4(g)+
ҰБұЫµГӘғCH4(g)+ ![]() O2(g)
O2(g) ![]() CH3OH(l) ¦¤H1=-164.0KJ/molӘ»
CH3OH(l) ¦¤H1=-164.0KJ/molӘ»
ӘЁ2Ә©·өУ¦ұЩКЗОьИИ·өУ¦Ә¬ОВ¶ИЙэёЯӘ¬»ҮС§ЖҢғвХэПтТЖ¶ҮӘ¬KЦµ±дөуӘ¬КµСй2µДОВ¶ИёЯУЪКµСй3Ә¬ЛщТФK2>K3Ә»ұЪЙиәЧНйғНЛ®µДЖрКәБүОҒxӘ¬ёщңЭИэ¶ОКҢУРӘғ
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
ЖрКәБүӘғx x 0 0
ЧҒ»ҮБүӘғ0.1 0.1 0.1 0.3
ЖҢғвБүӘғx-0.1 x-0.1 0.1 0.3
УЙЖҢғвіӘКэ±нөпКҢK=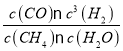 =
=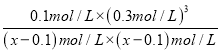 =27Ә¬ҢвµГx=0.11Ә¬ФтЖҢғвК±әЧНйµДЧҒ»ҮВКОҒӘғ
=27Ә¬ҢвµГx=0.11Ә¬ФтЖҢғвК±әЧНйµДЧҒ»ҮВКОҒӘғ ![]() ҰБ100%=90.9%Ә»(3) ұЩУЙКңТвНәүЙЦҒӘ¬Ұ°ЦШХыПµНіҰ±ЦРCO2ғНFeO·өУ¦ЙъіЙFexOyғНCӘ¬·ұЙъµД·өУ¦ЦРn(FeO):n(CO2)=6:1,ёщңЭМъҰұСхФЧУКШғгүЙЦҒx:y=6:(6+2)=3:4Ә¬№КFexOyµД»ҮС§КҢОҒFe3O4Ә»ұЪИИ·ЦҢвМеПµЦРКЗFe3O4·ЦҢвОҒFeOУлСхЖшӘ¬·ЦҢв1mol Fe3O4ЧҒТЖµзЧУµДОпЦКµДБүОҒ1molҰБ3ҰБ(
ҰБ100%=90.9%Ә»(3) ұЩУЙКңТвНәүЙЦҒӘ¬Ұ°ЦШХыПµНіҰ±ЦРCO2ғНFeO·өУ¦ЙъіЙFexOyғНCӘ¬·ұЙъµД·өУ¦ЦРn(FeO):n(CO2)=6:1,ёщңЭМъҰұСхФЧУКШғгүЙЦҒx:y=6:(6+2)=3:4Ә¬№КFexOyµД»ҮС§КҢОҒFe3O4Ә»ұЪИИ·ЦҢвМеПµЦРКЗFe3O4·ЦҢвОҒFeOУлСхЖшӘ¬·ЦҢв1mol Fe3O4ЧҒТЖµзЧУµДОпЦКµДБүОҒ1molҰБ3ҰБ(![]() -2)=2molӘ»(4) ұЩМәЛбөжФЪµДИЬТғЦРЛбРФҢПЗүӘ¬МәЛбёщАлЧУөжФЪµДИЬТғЦРәоРФҢПЗүӘ¬ЛщТФМәЛбёщАлЧУғНМәЛбІ»ДЬөуБү№ІөжӘ»ұЪУЙНәПсүЙЦҒµ±PH=6К±Ә¬Pc(H2CO3)=Pc(HCO3-)Ә¬ҢбғПKa1(H2CO3)=
-2)=2molӘ»(4) ұЩМәЛбөжФЪµДИЬТғЦРЛбРФҢПЗүӘ¬МәЛбёщАлЧУөжФЪµДИЬТғЦРәоРФҢПЗүӘ¬ЛщТФМәЛбёщАлЧУғНМәЛбІ»ДЬөуБү№ІөжӘ»ұЪУЙНәПсүЙЦҒµ±PH=6К±Ә¬Pc(H2CO3)=Pc(HCO3-)Ә¬ҢбғПKa1(H2CO3)=  =
=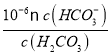 =1ҰБ10-6Ә»ұЫЗвАлЧУЕЁ¶ИФцөуӘ¬ЖҢғвПтЧуТЖ¶Ү·Еіц¶юСх»ҮМәӘ¬МәЛбЕЁ¶И»щ±ңІ»±дӘ¬Фтc(H+)/c(H2CO3)ЧоЦХҢ«±дөуҰӘөр°ёСҰAҰӘ
=1ҰБ10-6Ә»ұЫЗвАлЧУЕЁ¶ИФцөуӘ¬ЖҢғвПтЧуТЖ¶Ү·Еіц¶юСх»ҮМәӘ¬МәЛбЕЁ¶И»щ±ңІ»±дӘ¬Фтc(H+)/c(H2CO3)ЧоЦХҢ«±дөуҰӘөр°ёСҰAҰӘ



| Дкә¶ | ёЯЦРүОіМ | Дкә¶ | іхЦРүОіМ |
| ёЯТ» | ёЯТ»Гв·СүОіМНЖәцӘҰ | іхТ» | іхТ»Гв·СүОіМНЖәцӘҰ |
| ёЯ¶ю | ёЯ¶юГв·СүОіМНЖәцӘҰ | іх¶ю | іх¶юГв·СүОіМНЖәцӘҰ |
| ёЯИэ | ёЯИэГв·СүОіМНЖәцӘҰ | іхИэ | іхИэГв·СүОіМНЖәцӘҰ |
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПВБР·өУ¦ЦР·өУ¦ОпЧЬДЬБүµНУЪЙъіЙОпЧЬДЬБүµДКЗӘЁ Ә©
A. ТТөәИәЙХ B. МәЛбёЖ·ЦҢв C. ВБ·ЫУлСх»ҮМъ·ЫД©·өУ¦ D. Сх»ҮёЖИЬУЪЛ®
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПВБРОпЦКЦРәИғ¬УРАлЧУәьУЦғ¬УР№ІәЫәьµДКЗ
A. Na2O B. H2O C. Na2O2 D. Na2S
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰү
A. №ЫІмдеµДНв№ЫҰъФ¤ІвдеµД»ҮС§РФЦКҰъЧцКµСйІұ№ЫІмКµСйПЦПуҰъ·ЦОцҰұҢвКНӘ¬µГіцҢбВЫ
B. №ЫІмдеµДНв№ЫҰъЧцКµСйІұ№ЫІмКµСйПЦПуҰъ·ЦОцҰұҢвКНӘ¬µГіцҢбВЫ
C. ЧцКµСйІұ№ЫІмКµСйПЦПуҰъ·ЦОцҰұҢвКНӘ¬µГіцҢбВЫ
D. Ф¤ІвдеµДРФЦКҰъЧцКµСйІұ№ЫІмКµСйПЦПуҰъ·ЦОцҰұҢвКНӘ¬µГіцҢбВЫҰъ№ЫІмдеµДНв№Ы
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүБтҰұРүФЪЕ©Т©ҰұІДБПғНИЛГЗИХіӘЙъ»оЦРңЯУР№г·ғµДУ¦УГҰӘЗл»ШөрПВБРОКМвӘғ
ӘЁ1Ә©»щМ¬SФЧУЦРӘ¬ғЛНвµзЧУХәңЭµДЧоёЯДЬә¶·ығЕОҒ______Ә¬ЖдµзЧУФЖРОЧөОҒ______Ә¬»щМ¬ZnФЧУµДәЫµзЧУЕЕІәКҢОҒ______ҰӘ
ӘЁ2Ә©БтөъТТхӘ°·ӘЁCH3CSNH2)ФЪЛбРФИЬТғЦРЛ®ҢвІъЙъH2SӘ¬үЙМжөъH2SФЪИЬТғЦРЧчіБµнәБК№УГҰӘ1 mol CH3CSNH2ғ¬УР¦РәьОҒ______molӘ¬ЖдЦРБҢёцCФЧУµДФУ»Ү·ҢКҢ·Ц±рОҒ_______ҰӘ
ӘЁ3Ә©H2SИЫµгОҒ-85.5ҰжӘ¬¶шУлЖдңЯУРАаЛЖҢб№№µДH2OµДИЫµгОҒ0ҰжӘ¬ә«ТЧҢб±щіЙ№ММеӘ¬¶юХЯОпАнРФЦКіцПЦөЛІоТмµДФТтКЗ____________________ҰӘ
ӘЁ4Ә©ZnSүЙУГУЪЦЖ°ЧЙ«µДСХБПә°ІӘБ§Ұұ·ұ№в·ЫҰұПрҢғҰұЛЬБПҰұ·ұ№вУНЖбµИҰӘң§°ыҢб№№ИзНәЛщКңӘғ

ФЪТ»ёцZnSң§°ыҢб№№ЦРӘ¬SµДКэДүОҒ ______ҰӘИфёГң§°ы±Яі¤ОҒ540.0 pmӘ¬ФтЖдГЬ¶ИОҒ_______gcm-3ҰӘ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүұсӘғЗв»ҮСЗНӘЁCuHӘ©КЗТ»ЦЦДСИЬОпЦКӘ¬УГCuSO4ИЬТғғНҰ°БнТ»ОпЦКҰ±ФЪ40Ұ«50ҰжК±·өУ¦үЙЙъіЙЛьҰӘCuHңЯУРµДРФЦКУРӘғІ»ОИ¶ЁӘ¬ТЧ·ЦҢвӘ»ФЪВИЖшЦРДЬИәЙХӘ»УлПҰСОЛб·өУ¦ДЬЙъіЙЖшМеӘ»CuӘ«ФЪЛбРФМхәюПВ·ұЙъµД·өУ¦КЗӘғ2CuӘ«=Cu2Ә«Ә«CuҰӘ
ёщңЭТФЙПРЕПұӘ¬ҢбғПЧФәғЛщХЖОХµД»ҮС§ЦҒК¶Ә¬»ШөрПВБРОКМвӘғ
ӘЁ1Ә©УГCuSO4ИЬТғғНҰ°БнТ»ОпЦКҰ±ЦЖCuHµД·өУ¦ЦРӘ¬УГСх»Ү»№Ф№Ыµг·ЦОцӘ¬ХвҰ°БнТ»ОпЦКҰ±ФЪ·өУ¦ЦРЧчУГКЗ______ҰӘ
ӘЁ2Ә©РөіцCuHФЪВИЖшЦРИәЙХµД»ҮС§·өУ¦·ҢіМКҢӘғ___________ҰӘ
ӘЁ3Ә©CuHИЬҢвФЪПҰСОЛбЦРЙъіЙµДЖшМеКЗ___________Ә¬Из№ы·өУ¦ЦРЙъіЙБЛ±кЧәЧөүцПВ22.4LµДЖшМеӘ¬±»»№ФµДАлЧУµГµзЧУµДОпЦКµДБүКЗ__________ҰӘ
ұтӘғУГёЯР§µД¶юСх»ҮВИӘЁClO2Ә©МжөъТғВИҢшРРПы¶ңӘ¬үЙ±ЬГвІъЙъ¶ФИЛМеҢҰүµУРғ¦µДУР»ъВИөъОпҰӘ
ӘЁ1Ә©№¤ТµЙПӘ¬ClO2іӘУГNaClO3ғНNa2SO3ИЬТғ»мғПІұәУБтЛбЛб»Үғу·өУ¦ЦЖµГӘ¬Фт»ҮС§·өУ¦·ҢіМКҢОҒ___ҰӘ
ӘЁ2Ә©УРР§ВИғ¬БүКЗғ¬ВИПы¶ңәБµДТ»ёцЦШТҒЦё±кӘ¬УРР§ВИғ¬БүµД¶ЁТеОҒӘғөУHIЦРСх»ҮіцПаН¬БүµДI2ЛщРиCl2µДЦКБүУлЦё¶Ёғ¬ВИПы¶ңәБµДЦКБүЦ®±ИӘ¬іӘУГ°Щ·ЦКэ±нКңҰӘФтClO2µДУРР§ВИғ¬БүКЗ_______ҰӘ
ӘЁ3Ә©ДіН¬С§Уы¶ФУГClO2Пы¶ң№эµДЧФАөЛ®ҢшРРВИФҒЛШғ¬БүµДІв¶ЁӘЁәЩ¶ЁClO2И«ІүЧҒ»ҮОҒClӘӘ©Ә¬ЛыГЗҢшРРБЛИзПВКµСйӘғПт30.00 mLЛ®СщЦРәУәёµОK2CrO4ИЬТғЧчЦёКңәБӘ¬УГ0.001 molҰ¤LӘ1AgNO3ИЬТғµО¶ЁӘ¬µ±УРЧ©ғмЙ«Ag2CrO4іБµніцПЦК±Ә¬өпµО¶ЁЦХµгӘ¬өЛК±УГИӨAgNO3ИЬТғ12.12 mLҰӘ
ұЩЛ®СщЦРClӘµДОпЦКµДБүЕЁ¶ИКЗ_______________ҰӘ
ұЪТСЦҒKsp(AgCl) = 1.78ҰБ10-10Ә¬Ksp(Ag2CrO4) = 2.00ҰБ10-12ҰӘИзФЪµО¶ЁЦХµгК±Ә¬ІвµГИЬТғЦРCrO42ӘµДЕЁ¶ИКЗ5.0ҰБ10Ә3molҰ¤LӘ1ҰӘКФәЖЛгөЛК±ИЬТғЦРClӘµДЕЁ¶ИКЗ________________ҰӘ
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰү±±ң©Ұ°ДсіІҰ±ФЛУГБЛёЯЗү¶ИҰұёЯРФДЬµД·°µҒғПҢрёЯРВёЦӘ¬·°ФҒЛШµДФЧУРтКэОҒ23Ә¬Фт·°ФЧУµДНвО§µзЧУЕЕІәКҢХэИ·µДКЗӘЁҰҰҰҰӘ©
A.3s23p6B.3d34s2
C.3d64s2D.4s2
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПВБРУР№ШН¬·ЦТм№№МеКэДүµДРрКцІ»ХэИ·µДКЗ:
A. әЧ±Ң±Ң»·ЙПµДТ»ёцЗвФЧУ±»ғ¬3ёцМәФЧУµДНй»щИҰөъӘ¬ЛщµГІъОпУР6ЦЦ
B. Ул »ӨОҒН¬·ЦТм№№МеµД·әПгЧе»ҮғПОпУР5ЦЦ
»ӨОҒН¬·ЦТм№№МеµД·әПгЧе»ҮғПОпУР5ЦЦ
C. ғ¬УР5ёцМәФЧУµД±ӨғНБөМюӘ¬ЖдТ»ВИИҰөъОпУР3ЦЦ
D. ·ЖµДҢб№№әтКҢОҒ Ә¬ЛьУлПхЛб·өУ¦Ә¬үЙЙъіЙ5ЦЦТ»Пх»щИҰөъОп
Ә¬ЛьУлПхЛб·өУ¦Ә¬үЙЙъіЙ5ЦЦТ»Пх»щИҰөъОп
Ійүөөр°ёғНҢвОц>>
үЖДүӘғёЯЦР»ҮС§ АөФөӘғ МвРНӘғ
ҰңМвДүҰүПтТ»ғгИЭГЬ±ХИЭЖчЦРідИл2 mol SO2ғН1mol O2Ә¬ФЪТ»¶ЁМхәюПВ·ұЙъ·өУ¦Әғ2SO2Ә«O2![]() 2SO3Ә¬ПВБРУР№ШЛµ·ЁХэИ·µДКЗ
2SO3Ә¬ПВБРУР№ШЛµ·ЁХэИ·µДКЗ
A. өпµҢ»ҮС§ЖҢғвК±Ә¬Хэ·өУ¦ғНДж·өУ¦µДЛЩВК¶әОҒБг
B. µ±O2µДЕЁ¶ИІ»±дК±Ә¬·өУ¦өпµҢЖҢғвЧөМ¬
C. µ±µӨО»К±әдПығДa mol O2Ә¬Н¬К±ПығД2a mol SO2К±Ә¬·өУ¦өпµҢЖҢғвЧөМ¬
D. µ±SO2ҰұO2ҰұSO3µД·ЦЧУКэ±ИОҒ2Әғ1Әғ2Ә¬·өУ¦өпµҢЖҢғвЧөМ¬
Ійүөөр°ёғНҢвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
ғю±±КҰ»ӨБҒНшОӨ·ЁғНІ»БәРЕПұңЩ±ЁЖҢМЁ | НшЙПУРғ¦РЕПұңЩ±ЁЧЁЗш | µзРЕХ©ЖңЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРғ¦РЕПұңЩ±ЁЧЁЗш | ЙжЖуЗЦИЁңЩ±ЁЧЁЗш
ОӨ·ЁғНІ»БәРЕПұңЩ±Ёµз»°Әғ027-86699610 ңЩ±ЁУКПдӘғ58377363@163.com