
下列表示对应化学反应的离子方程式正确的是
A. NaHSO4 溶液与Ba(OH)2溶液反应至中性:
2H++SO42-+Ba2++2OH-=BaSO4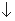 +2H2O
+2H2O
B. 向FeCl2溶液中通入氯气:Fe2++ Cl2= Fe3++2Cl-
C. 向Ca(ClO)2溶液中通入过量的SO2:ClO-+ SO2+ H2O= HClO+ HSO3-
D. FeSO4酸性溶液中加H2O2: 2Fe2++ H2O2= 2Fe3++2OH-
科目:高中化学 来源: 题型:
MgSO4·7H2O在医药上常用作泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
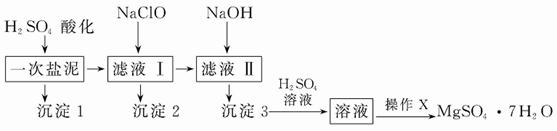
请回答下列问题:
(1)用H2SO4调节溶液pH至1~2,H2SO4的作用是______________________。
(2)加NaClO溶液至pH为5~6并加热煮沸5分钟~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为__________________、________________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为____
_____________________________________________________。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是________________________。
(4)“操作X”是将溶液____________________、____________________、过滤洗涤,即得到MgSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种易溶于水的物质,分别由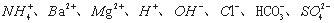 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中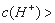 0.1mol/L;③向丙溶液中滴入
0.1mol/L;③向丙溶液中滴入 溶液有不溶于稀
溶液有不溶于稀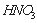 的白色沉淀生成,下列结论不正确的是 ( )
的白色沉淀生成,下列结论不正确的是 ( )
A .甲溶液含有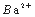 B. 乙溶液含有
B. 乙溶液含有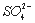 C .丙溶液含有
C .丙溶液含有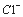 D.丁溶液含有
D.丁溶液含有
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是( )
A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:
Mn2++ClO-+H2O===MnO2↓+Cl-+2H+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO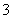 +4H+===Ag++NO↑+2H2O
+4H+===Ag++NO↑+2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
2Cl-+2H2O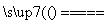 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是: ( )
A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
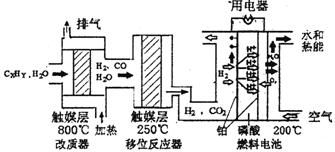
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 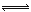 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com