
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
【答案】(1)①3d24s2;②7;
(2)①O>Cl>C;②3∶1;sp2;
(3)>;
(4)①LaNi5;②M/NAd;③1236
【解析】
试题分析:(1)①Ti是22号元素,位于元素周期表中第四周期第IVB族,故Ti的基态原子价电子排布式为 3d24s2,故答案为:3d24s2;
②Fe是26号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C,故答案为:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+![]() ×(41×22)=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
×(41×22)=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点。所以晶胞实际含有的镍原子为1×1+![]() ×8=5,晶胞实际含有的镧原子为8×
×8=5,晶胞实际含有的镧原子为8×![]() =1,所以晶体的化学式LaNi5,故答案为:LaNi5;
=1,所以晶体的化学式LaNi5,故答案为:LaNi5;
②一个晶胞的质量m=![]() ,根据m=ρv,即v=
,根据m=ρv,即v=![]() ,故答案为:
,故答案为:![]() ;
;
③LaNi5合金储氢后的密度ρ=![]() =
=![]() =0.111gcm-3,由定义式:储氢能力=
=0.111gcm-3,由定义式:储氢能力=![]() ,故储氢能力=
,故储氢能力=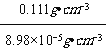 ≈1236,故答案为:1236。
≈1236,故答案为:1236。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
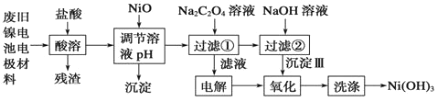
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。![]() H2O > NiC2O4
H2O > NiC2O4![]() 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一 ![]() Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一![]() Ni2O3+3 H2O
Ni2O3+3 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化学基本工业产品,工业上有很多不同的方法生产纯碱。
Ⅰ、路布兰法——其生产原理:用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙。
(1)请写出上述过程的化学方程式:____________。
Ⅱ.索尔维制碱法:以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,首先得到小苏打,再加热分解小苏打,获得纯碱。
(2)结合下图中所给物质的溶解度曲线。写出得到小苏打的离子方程式:____________。
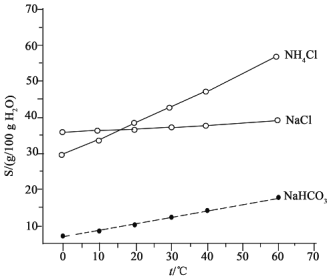
(3)这种生产方法的优点是原料便宜、产品纯度高、氨和部分二氧化碳可以循环使用。请写出实现氨循环的化学方程式:____________。
Ⅲ.侯德榜制碱法——生产流程可简要表示如下:
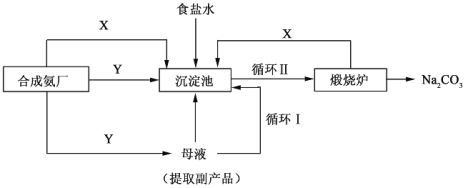
(4)合成氨工厂需要向制碱厂提供两种原料气体,其中Y是____________(填化学式),这两种气体在使用过程中是否需要考虑通入的先后顺序____________(填”是”或“否”),原因是____________。
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了____________(填流程中的编号)使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得的副产品的应用:____________(举一例)。
(6)该合成氨厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的____________%(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
实验序号 | 起始读数/mL | 终点读数/mL |
I | 2.50 | 22.58 |
Ⅱ | 1.00 | 23.12 |
Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)![]() H3CuCl4(aq)。
H3CuCl4(aq)。
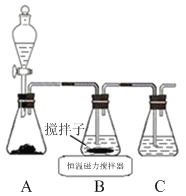
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O===2CuCl43-+SO+4H+
CuCl43-(aq)![]() CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
①装置C的作用是 。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
![]()
操作ⅱ的主要目的是
操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案: 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
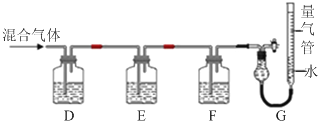
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
①D、F洗气瓶中宜盛放的试剂分别是 、 。
②写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D、E为中学化学常见的金属单质且D常呈红棕色,F是一种黑色晶体。E与C的浓溶液在常温作用呈钝化现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图:

(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式____。
(2)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
A.氯水和KSCN溶液 B.氢氧化钠溶液 C.酸性KMnO4溶液
(3)用惰性电极电解一定浓度的A的水溶液,阳极反应式为_____________________,通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度,则电解过程中收集到标准状况下的气体体积为多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的反应往往伴随副反应发生,因此 需要分离提纯。有一种水果香精的合成步骤如下:
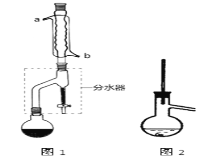
Ⅰ合成:
在干燥的圆底烧瓶中加入11.5 mL(9.3 g,0.125 mol)正丁醇、7.2 mL(7.5 g,0.125 mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00 mL水,其水面低于分水器回流支管下沿3~5 mm,然后用小火加热,反应大约40 min。
Ⅱ分离提纯:
① 将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10 mL水、10 mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层。
② 将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥。
③ 将乙酸正丁酯粗产品转入50 mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品。
主要试剂及产物的物理常数如下:
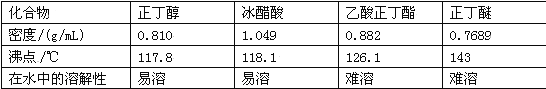
制备过程中还可能有的副反应:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
(1)合成和分离过程中均使用沸石,其作用________________________ 。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______(填a或b)管口通入。
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先_______(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________杂质。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点_______________ 。
(6)反应结束后,若放出的水为6.98 mL(水的密度为1g/mL),则正丁醇的利用率约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。

下列有关说法正确的是( )
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上通过氯碱工业制取金属钠
C.从第③步到第⑤步的目的是浓缩、富集溴单质
D.第②步的反应条件是高温加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com