
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变仅将容器的体积缩小一半,反应速率减小
B. 反应达平衡状态时:v正(CO)=v逆(H2O)
C. 保持体积不变,充入少量He使体系压强增大,反应速率一定增大
D. 其他条件不变,适当增加C(s)的质量会使反应速率增大
科目:高中化学 来源: 题型:
【题目】下列各组晶体类型完全不一样的一组是( )
A.CaO,NO,CO
B.CCl4、H2O2、He
C.CO2、SiO2、NaCl
D.CH4、O2、Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为_________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。
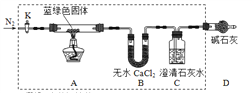
请回答下列问题:
(1)假设2中的沉淀为___________________。
(2)假设1中沉淀为Cu(OH)2的理论依据是(用离子方程式表示)____________。
(3)无水乙醇洗涤的目的_______________________________________。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明___________成立。(填写“假设1” “假设2”或“假设3”)。
(5)乙同学认为只要将上图中B装置的试剂改用______试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对1mol·L-1的Na2SO4溶液叙述正确的是
A. 溶液中含有1mol Na2SO4 B. 1mol Na2SO4溶于1L水中
C. 可与1mol·L-1 BaCl2溶液完全反应 D. 1L溶液中含142g Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 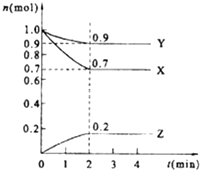
(1)由图中所给数据进行分析,该反应的化学方程式为;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n (X)=n (Y)=n (Z),则原混合气体中a:b= .
(4)下列措施能加快反应速率的是(多选).
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(5)下列说法正确的是(单选).
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度是不可能改变的
D.增大Y的浓度,正反应速率加快,逆反应速率减慢.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:

(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。

(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g) +6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)(3)反应III是利用右上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图判断,下列说法正确的是( )

A. 装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-Fe2+
B. 装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-4OH-
C. 装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D. 放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com