
 .
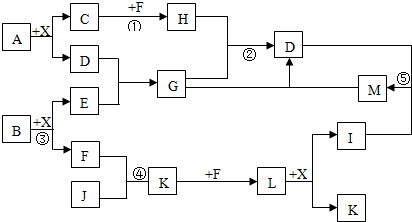
. 分析 由X为无色液体,则X为H2O;C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,B的焰色反应呈黄色,结合转化关系图可知,B为Na2O2,E为NaOH,F为O2,L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,I为HNO3;L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;
又D遇I溶解,可知I为强酸,C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合A中某元素的质量分数为25%,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,M为Al(OH)3和I为HNO3,反应生成为Al(NO3)3,因为B+水生成NaOH+O2,B为Na2O2,均符合图中转化,然后结合元素化合物性质及化学用语来解答.
解答 解:由X为无色液体,则X为H2O;C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,B的焰色反应呈黄色,结合转化关系图可知,B为Na2O2,E为NaOH,F为O2,L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,I为HNO3;L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;又D遇I溶解,可知I为强酸,C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合A中某元素的质量分数为25%,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,M为Al(OH)3和I为HNO3,反应生成为Al(NO3)3,因为B+水生成NaOH+O2,B为Na2O2.符合图中转化,
(1)由上述分析可知,A为Al4C3,故答案为:Al4C3;
(2)反应①为甲烷与氧气的反应,反应③为过氧化钠与水的反应,反应④是氨气的催化氧化反应,这三个反应中均存在元素的化合价变化,为氧化还原反应,
故答案为:①③④;
(3)反应③化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)反应②的离子反应为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-),G溶液与M溶液的反应为G为NaAlO2,M为Al(OH)3和I为HNO3,反应生成为Al(NO3)3,G与M反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-),Al3++3AlO2-+6H2O=4Al(OH)3↓;
(5)3.4gNH3的物质的量为0.2mol,放出aKJ热量,则4molNH3放出20aKJ热量,故该反应的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-20aKL/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-20aKL/mol.
(6)①HgCl2和Hg(CN)2反应可制得(CN)2,依据原子守恒写出反应方程式为:HgCl2+Hg(CN)2=Hg2Cl2+(CN)2,(CN)2属于共价化合价电子式为: ,
,
故答案为:HgCl2+Hg(CN)2=Hg2Cl2+(CN)2, ;
;
点评 本题考查无机物的推断,为高频考点,把握B的焰色、X为水等为解答本题的突破口,侧重钠、铝及其化合物转化的考查,注意发生的氧化还原反应、相互促进水解反应来推断各物质,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 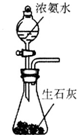 所示装置可制备氨气 | |
| B. | 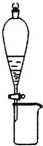 所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. | 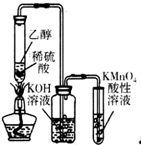 所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验目的或结论 |
| A | 向某有机物中加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀 | 该有机物一定是醛 |
| B | 将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 | 证明CH3CH2Br未发生水解 |
| C | 分别给乙醇和苯酚溶液中加入紫色石蕊试液,观察其颜色的变化 | 比较乙醇和苯酚的酸性强弱 |
| D | 用pH试纸测定CH3COONa溶液的pH | 证明CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com