
【题目】有物质的量浓度均为0.1mo/L的下列溶液:
(1)①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,其pH由大到小的顺序排列的是(填序号)___。
(2)写出氯化亚铁溶液中,亚铁离子水解的离子方程式___。
(3)写出硫酸氢钠与氢氧化钡2:1反应的离子方程式___。
(4)将氢氧化钾与氯化亚铁溶液混合,现象___。依次发生的化学方程式____、___。
(5)氯化亚铁保存时为何加少量铁粉___,若保存硫酸铁溶液时应向溶液中加入____。
(6)如何利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,写出加入试剂的先后顺序和对应现象__。
【答案】⑤④①②③⑥ Fe2++ 2H2O![]() 2Fe(OH)2+ 2H+ Ba2++ 2H++SO42- + 2OH- == BaSO4↓ + 2H2O 先生成白色沉淀,后迅速变灰绿色,最终变为红褐色 2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl 4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3 防止亚铁离子被氧化 稀硫酸 取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+
2Fe(OH)2+ 2H+ Ba2++ 2H++SO42- + 2OH- == BaSO4↓ + 2H2O 先生成白色沉淀,后迅速变灰绿色,最终变为红褐色 2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl 4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3 防止亚铁离子被氧化 稀硫酸 取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+
【解析】
⑴①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,六者显酸性的有③NaHSO4,②FeCl2,⑥H2SO4,⑥H2SO4酸性更强,③NaHSO4,电离显强酸性,但比硫酸酸性弱,②FeCl2是水解显酸性,酸性较弱,三者pH从大到小依次②FeCl2,③NaHSO4,⑥H2SO4,六者显碱性的有①NH3·H2O,④KOH,⑤Ba(OH)2,其中④KOH,⑤Ba(OH)2是强碱电离显碱性,且氢氧化钡电离出的氢氧根多,碱性更强,①NH3·H2O是弱电解质,电离显弱碱性,故三者pH从大到小顺序为⑤Ba(OH)2,④KOH,①NH3·H2O,因此六者pH从大到小顺序为⑤④①②③⑥;
⑵氯化亚铁溶液中,亚铁离子水解的离子方程式Fe2++ 2H2O![]() 2Fe(OH)2+ 2H+,故答案为Fe2++ 2H2O
2Fe(OH)2+ 2H+,故答案为Fe2++ 2H2O![]() 2Fe(OH)2+ 2H+;
2Fe(OH)2+ 2H+;
⑶假设2 mol硫酸氢钠溶液中电离出2 mol 氢离子、2 mol硫酸根离子、2 mol钠离子
1 mol氢氧化钡溶液电离出1 mol钡离子、2 mol氢氧根离子,因此分析得出氢氧根和氢离子反应完,硫酸根只反应了1 mol,故离子方程式为Ba2++ 2H++SO42- + 2OH- == BaSO4 ↓+ 2H2O;故答案为Ba2++ 2H++SO42- + 2OH- == BaSO4↓+ 2H2O;
⑷将氢氧化钾与氯化亚铁溶液混合,现象先生成白色沉淀,后迅速变灰绿色,最终变为红褐色,依次发生的化学方程式2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl、4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3,故答案为先生成白色沉淀,后迅速变灰绿色,最终变为红褐色;2KOH+ FeCl2 == Fe(OH)2 ↓+ 2KCl、4Fe(OH)2+ O2+ 2H2O==4Fe(OH)3;
⑸氯化亚铁保存时为何加少量铁粉防止亚铁离子被氧化,若保存硫酸铁溶液时应向溶液中加入稀硫酸以防止其发生水解,故答案为防止亚铁离子被氧化;稀硫酸;
⑹利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,加入试剂的先后顺序和对应现象为:取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+。故答案为:取少溶液于试管,向试管中加入KSCN,无现象,再向溶液中滴加少量氯水,溶液变为红色,则溶液中含有Fe2+。


科目:高中化学 来源: 题型:
【题目】过氧化钠(Na2O2)是一种淡黄色固体,有两个实验小组的同学为探究其与二氧化碳的反应,都用下图所示的装置进行实验。一段时间后,将带余烬的木条插入试管D中,木条复燃。
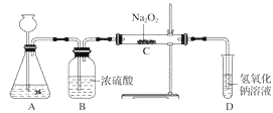
请回答下列问题:
(1)A是制取CO2的装置,写出A中发生反应的化学方程式:__________。
(2)第1小组同学认为Na2O2与CO2反应生成了Na2CO3和O2,该反应的化学方程式为________。
(3)第2小组同学认为除生成Na2CO3和O2外,还有可能生成NaHCO3,你认为呢?并简述原因_____。
(4)请设计一种实验方案证明Na2O2与CO2反应生成了Na2CO3: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料![]() ,其工艺流程如图所示:
,其工艺流程如图所示:
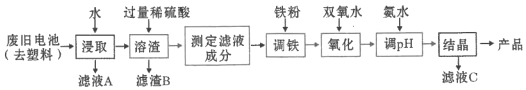
(1)碱性锌锰电池的工作原理:________![]() ________
________![]() ________
________![]() ________
________![]() ________(配平方程式),其中的电解质溶液是
________(配平方程式),其中的电解质溶液是![]() 溶液。滤液
溶液。滤液![]() 中主要溶质的电子式为______。
中主要溶质的电子式为______。
(2)已知![]() 中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为________。
中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中锰元素的化合价相同,则铁元素的化合价为________。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将![]() 价锰的化合物全部还原成
价锰的化合物全部还原成![]() ,写出该反应的离子方程式________。
,写出该反应的离子方程式________。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式![]() 相符合。
相符合。
①写出“调铁”工序中可能发生反应的离子方程式________,________。
②若“测定滤液成分”结果为![]() ,
,![]() ,滤液体积为
,滤液体积为![]() ,“调铁”工序中,需加入的铁粉质量为________
,“调铁”工序中,需加入的铁粉质量为________![]() (忽略溶液体积变化,用含
(忽略溶液体积变化,用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(5)在“氧化”工序中,加入双氧水的目的是把![]() 氧化为
氧化为![]() ;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是________。
;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是________。
(6)从滤液![]() 中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为________。
中还可分离出一种氮肥,该氮肥的溶液中的离子浓度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示,回答下列问题。

(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是______________________。
(2)工厂废液中加入过量A的目的是______________________________。
(3)溶液甲中的金属离子是_____________________(写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是________(填序号)。
(5)步骤③中发生反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用aLpH=3的HX溶液与bLpH=11的氢氧钠溶液相混合,下列叙述正确的( )
A.若两者恰好中和,则一定是a=b
B.若混合液显碱性,则一定是b≥a
C.若混合液显中性,则一定是a≤b
D.若混合液显酸性,则一定是a≥b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为易挥发液体,C为气体。
D、E、F、G、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
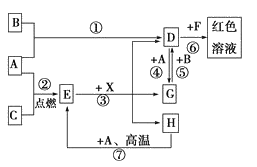
(1)写出化学式:A___,D___,E___,X___。
(2)在反应①~⑦中,不属于氧化还原反应的是____。(填编号)
(3)反应⑥的离子方程式为____。
(4)反应⑦的化学方程式为____。
(5)该反应中每消耗0.3mol的A,可转移电子___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓H2SO4来配制500mL0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥托盘天平⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有_____________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(填序号)(选填①10mL、②50mL、③100mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度小于0.2 mol/L。请你分析配制过程中可能引起浓度偏低的原因是___________(填字母)。
a.定容时俯视标线 b.烧杯和玻璃棒没有洗涤
c.加蒸馏水不慎超过刻度线 d.容量瓶使用前内壁沾有水珠
e.定容时仰视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒![]() 为主的某石煤为原料(含有
为主的某石煤为原料(含有![]() 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备![]() ,其流程如下:
,其流程如下:
![]()
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
|
|
|
|
(1)焙烧:向石煤中加生石灰焙烧,将![]() 转化为
转化为![]() 的化学方程式是________________。
的化学方程式是________________。
(2)酸浸:![]() 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的![]() ,
,![]() 溶于盐酸的离子方程式是________________。
溶于盐酸的离子方程式是________________。
(3)转沉:将浸出液中的钒转化为![]() 固体,其流程如下:
固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是____________________________________。
②向![]() 溶液中加入
溶液中加入![]() 溶液,控制溶液的
溶液,控制溶液的![]() 。当
。当![]() 时,
时,![]() 的产量明显降低,原因是_______________________________________。
的产量明显降低,原因是_______________________________________。
(4)实验室以![]() 为原料还可以合成用于制备
为原料还可以合成用于制备![]() 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
![]()
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:![]() 能被
能被![]() 氧化。
氧化。
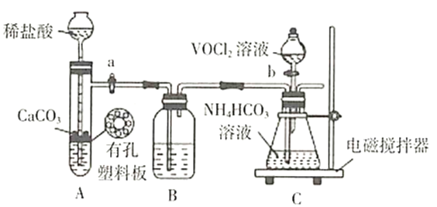
药品填装完成后的实验操作是________(填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加![]() 的
的![]() 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%![]() 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的![]() ,最后用
,最后用![]() 的
的![]() 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: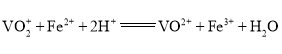 )。
)。
![]() 溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com