
| m |
| M |
| ||
| 84g/mol |
| ||
| 100g/mol |
| ||
| 84g/mol |
| a |
| 168 |
| ||
| 100g/mol |
| a |
| 200 |
| a |
| 168 |
| a |
| 200 |
| 23a |
| 2100 |
| 23a |
| 2100 |
| a |
| 168 |
| a |
| 200 |
| a |
| 168 |
| a |
| 200 |
| a |
| 168 |
| a |
| 200 |
| 23a×22.4 |
| 2100 |
| 23a×22.4 |
| 2100 |
| ag |
| 84g/mol |
| a |
| 84 |
| a |
| 84 |
| ag |
| 100g/mol |
| a |
| 100 |
| a |
| 100 |
| a |
| 100 |
| a |
| 84 |
| 22.4a |
| 100 |
| 22.4a |
| 84 |
| 22.4a |
| 100 |
| 22.4a |
| 84 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 被提纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(苯甲酸) | 生石灰 | 蒸馏 |
| B | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙烷(乙炔) | 酸性高锰酸钾溶液 | 洗气 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| B、新制氯水中只含Cl2和H2O分子 |
| C、光照氯水有气泡放出,该气体主要是Cl2 |
| D、氯水放置数天后酸性将减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑩ | ⑧ | ⑨ | ||
| 第4周期 | ② | ④ |
| ⑩ | ① | ⑦ | ⑨ | ⑤ | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 |
查看答案和解析>>
科目:高中化学 来源: 题型:
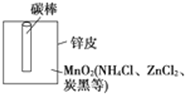 某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质.整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质.整个实验过程如下,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com