
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反应的催化剂 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 | |
| D. | 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 药品柜 | 甲 | 乙 | 丙 | 丁 |
| 药品 | 硫黄、红磷 | 镁、锌 | 硫酸、硝酸 | 氢氧化钠、氢氧化钙 |
| A. | 甲柜 | B. | 乙柜 | C. | 丙柜 | D. | 丁柜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
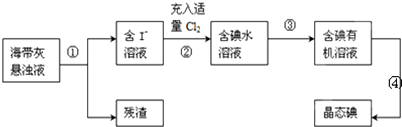
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com