
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由弱至强的顺序是X<Y<Z | |
| C. | 原子半径大小顺序是X<Y<Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
分析 X、Y、Z三种元素的原子具有相同电子层数,应为同一周期元素,它们的最高价氧化物对应水化物是H3XO4、H2YO4、HZO4,则X的最外层电子数为5,Y的最外层电子数为6,Z的最外层电子数为7,为非金属,原子序数X<Y<Z,根据同一周期元素的非金属性的递变规律以及元素的性质与对应单质、化合物的性质的关系解答该题.
解答 解:X、Y、Z三种元素的原子具有相同电子层数,应为同一周期元素,它们的最高价氧化物对应水化物是H3XO4、H2YO4、HZO4,则X的最外层电子数为5,Y的最外层电子数为6,Z的最外层电子数为7,为非金属,原子序数X<Y<Z,
A.根据分析可知,原子序数X<Y<Z,故A错误;
B.它们最高价氧化物的水化物的酸性强弱顺序是H3XO4<H2YO4<HZO4,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以非金属性:X<Y<Z,故B正确;
C.同周期,从左到右随原子序数的增大,原子半径减小,则原子半径为X>Y>Z,故C错误;
D.元素的非金属性越强,对应的氢化物的稳定性越强,非金属性:X<Y<Z,则气态氢化物稳定性:H3X<H2Y<HZ,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,明确同周期元素性质的变化规律及非金属性与最高价氧化物对应水化物的酸性的关系是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
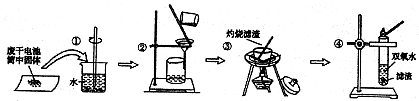
| A. | 操作①中玻璃棒的作用是加快固体溶解速度 | |
| B. | 取操作2的溶液于试管中,滴加适量氢氧化钠稀溶液,并用湿润的红色石蕊试纸放于试管口,发现试纸变蓝,可以证明有NH4Cl的存在 | |
| C. | 操作③中盛放药品的仪器是坩埚 | |
| D. | 操作④的目的是检验MnO2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①②④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HI>HBr>HCl>HF | B. | 碱性:Be(OH)2<Mg(OH)2<KOH | ||
| C. | 氧化性:S<O2<F2 | D. | 还原性:O2-<S2-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.15mol/L | D. | 0.05mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com