
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ③④⑤⑥ | D. | ①④⑤⑥ |
分析 ①计算平均碳原子数目判断;
②反应燃烧前后气体的体积不变(水为气体),则平均分子式中H原子数目为4,可以为乙烯、丙炔等;
③计算平均H原子数目判断;
④由相对氢气密度,可知混合烃的平均相对分子质量为20;
⑤混合气体C、H原子数目之比1:3,而小于1:3的只有甲烷;
⑥计算水的物质的量,可得混合气体中H原子物质的量,结合混合气体总质量计算C原子物质的量,再结合C、H原子数目之比判断.
解答 解:①混合气体平均碳原子数目为$\frac{1.5mol×1}{1mol}$=1.5,所有烃中只有甲烷的碳原子数目小于1.5,则一定含有甲烷,故选;
②设平均分子式为CxHy,则:CxHy+(x+$\frac{y}{4}$)$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),反应燃烧前后气体的体积不变,则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,故y=4,甲烷、乙烯、丙炔等分子中都含有4个H原子,不一定含有甲烷,故不选;
③水的物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,则分平均H原子数目为$\frac{0.6mol×2}{0.3mol}$=4,甲烷、乙烯、丙炔等分子中都含有4个H原子,不一定含有甲烷,故不选;
④由相对氢气密度,可知混合烃的平均相对分子质量为10×2=20,烃中相对分子质量小于20的只有甲烷,则一定含有甲烷,故选
⑤混合气体C、H原子数目之比1:3,而小于1:3的只有甲烷,故选;
⑥水的物质的量为$\frac{108g}{18g/mol}$=6mol,氢原子物质的量为12mol,则C原子物质的量为$\frac{60g-12mol×1g/mol}{12g/mol}$4mol,混合气体C、H原子数目之比1:3,而小于1:3的只有甲烷,故选.
故选:D.
点评 本题考查有机物分子式确定、混合物计算,注意利用平均值解答,常用平均值有:平均碳法、平均氢法、平均分子式、平均相对分子质量、平均碳氢法的等.


科目:高中化学 来源: 题型:选择题
| A. | 沸点:正戊烷>2-甲基丁烷>乙烷 | B. | 同分异构体种类:戊烯<戊烷 | ||
| C. | 密度:苯<水<硝基苯 | D. | 含碳量:乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{49}$ | B. | 49 | C. | $\frac{1}{7}$ | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电流的作用下,氖原子与构成灯管的物质发生反应 | |
| B. | 电子由激发态向基态跃迁时以光的形式释放能量 | |
| C. | 氖原子获得电子后转变成发出红光的物质 | |
| D. | 电子由基态向激发态跃迁时吸收除红光以外的光线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的浓度不再发生变化 | B. | 消耗Z的速率是生成X的速率的2倍 | ||
| C. | 气体总质量保持不变 | D. | X、Y、Z的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| D | ||
| A | B | C |
| E |
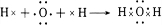 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族元素的原子序数的差不可能为10 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 过渡元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8(>8溶解) | 9(>9溶解) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com