
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
 Si+2CO↑,C项合理;由于硫化铜、硫化汞是难溶于水的电解质,溶度积很小,硫化钠是易溶于水、易电离的钠盐,加入硫化钠作沉淀剂,S2-与Cu2+和Hg2+容易结合成CuS沉淀、HgS沉淀,从而降低废水中Cu2+和Hg2+的浓度,当它们均小于10-5mol/L时,可以认为被沉淀完全而除去,D项合理。
Si+2CO↑,C项合理;由于硫化铜、硫化汞是难溶于水的电解质,溶度积很小,硫化钠是易溶于水、易电离的钠盐,加入硫化钠作沉淀剂,S2-与Cu2+和Hg2+容易结合成CuS沉淀、HgS沉淀,从而降低废水中Cu2+和Hg2+的浓度,当它们均小于10-5mol/L时,可以认为被沉淀完全而除去,D项合理。

科目:高中化学 来源:不详 题型:单选题
| A.溶液中水电离出的OH-的个数:②>① |
| B.溶液中阴离子的物质的量浓度之和:②>① |
| C.①溶液中:c(CO32-)<c(H2CO3) |
| D.②溶液中:c(HCO3-)<c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
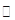 SO2 +2Cu。
SO2 +2Cu。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沉淀中只有Fe(OH)3 | B.沉淀中有Fe(OH)3和Fe(OH)2 |
| C.滤液c(Fe3+)=4.0×10-8mol/L | D.向滤液中滴加FeCl2溶液,无沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4 | B.CuCO3 | C.Cu(OH)2 | D.CuS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
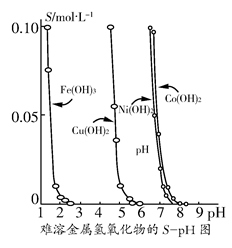
| 物质 | FeS | MnS | CuS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com