
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
分析 a、b、c、d是原子序数依次增大的主族元素,它们的最外层电子数分别为4、1、x、7,c原子的电子层数等于x,可知c的周期数=族序数,则c应为Al,d-的电子层结构与氩相同,则d为Cl,结合原子序数可知a为C,b为Na,然后结合元素化合物知识及元素周期律来解答.
解答 解:a为C、b为Na、c为Al、d为Cl元素,
A.元素a与氢元素能形成多种原子个数之比为1:1的化合物,如乙炔、苯等,故A正确;
B.Na与水、乙醇反应生成氢气,故B正确;
C.Al3+与Cl-的最外层电子数都为8,故C错误;
D.a与d形成的化合物含有C-Cl键,为极性共价键,故D正确.
故选C.
点评 本题考查原子结构与元素周期律的关系,为高频考点,把握元素化合物性质、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 65gKHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶体 | |
| C. | 常温常压下,7.0g乙烯与丙烯的混合物中含有碳氢键的数目为NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
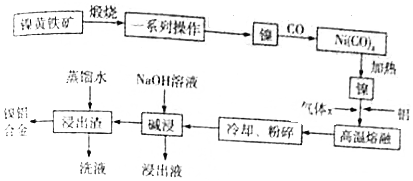
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com