
【题目】某实验小组在常温下进行电解饱和Ca(OH)2溶液的实验,实验装置与现象见下表。
序号 | I | II |
装置 |
|
|
现象 | 两极均产生大量气泡,b极比a极多;a极溶液逐渐产生白色浑浊,该白色浑浊加入盐酸有气泡产生 | 两极均产生大量气泡,d极比c极多;c极表面产生少量黑色固体;c极溶液未见白色浑浊 |
下列关于实验现象的解释与推论,正确的是( )
A. a极溶液产生白色浑浊的主要原因是电解过程消耗水,析出Ca(OH)2固体
B. b极产生气泡:4OH- -4e- === O2↑ +2H2O
C. c极表面变黑:Cu -2e- +2OH- === CuO +H2O
D. d极电极反应的发生,抑制了水的电离
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)

下列关于元素R的判断中一定正确的是( )
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,充入10 mol N2和22mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡时N2的转化率为60%,求:
(1)平衡时v (NH3) 的速率__________。
(2)求该温度下的平衡常数K(列出算式,算出结果)________。
(3)H2在平衡混合气体中的体积分数(即物质的量分数)________。
(4)平衡时容器的压强与起始时压强之比(即物质的量之比)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A. 用过量氨水除去烟气中的二氧化硫:SO2 +2NH3·H2O === (NH4)2SO3+H2O
B. 呼吸面具中用过氧化钠吸收二氧化碳产生氧气:2Na2O2+2CO2 ===2Na2CO3+O2
C. 电解饱和氯化钠溶液产生气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
D. 用浓硝酸除去试管内壁上附着的铜:8H+ +2NO3- +3Cu === 3Cu2+ +2NO↑ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,利用SRB(硫酸盐还原菌)治理废水中的有机物、SO42-及重金属污染取得了新的进展。
(1)下图表示H2CO3和H2S在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样pH=8.5,在SRB的作用下,废水中的有机物(主要为CH3COO─)将SO42-还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:_______________。
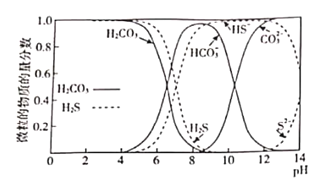
(2)SRB除去废水中有机物的同时,生成的H2S还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如下图所示。

①写出电池正极的电极反应:________________。
②负极室的pH随反应进行发生的变化:__________(“减小”或“增大”),结合电极反应解释pH变化的原因:__________。
(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将Sb(OH)6-转化为Sb2S3除去,转化过程中有单质生成。完成第一步反应的离子方程式。
第一步: Sb(OH)6-+ H2S ===1 + 1 ↓+ H2O,_______________________
第二步:3H2S +2SbO2-+2H+ ===Sb2S3↓ +4H2O
②某小组模拟实验时配制amL含Sb元素b mg·L-1 的废水,需称取________gKSb(OH)6(相对分子质量为263)。提示:列出计算式即可。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容中反应:2NO2(g)![]() 2NO(g)+O2(g),能说明反应达平衡状态的是:
2NO(g)+O2(g),能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子H是一种成膜良好的树脂,其合成路线如下:

已知:①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示只有一组峰;
② ![]()
(1)A的结构简式为 ____________________________,G中官能团名称为_________________
(2)由B生成C的化学方程式为___________________________________________________。
(3)D的系统命名为_________________。
(4)化合物E的沸点 ______ (选填“>”,“<”或者“=”)2-甲基丙烷。
(5)F与新制Cu(OH)2悬浊液反应的化学方程式为____________________________________。
(6)H的结构简式为________________________________________。
(7) 的符合下列条件的同分异构体有____种
的符合下列条件的同分异构体有____种
①分子中无环状结构且无支链 ②核磁共振氢谱有两组峰,峰面积之比为3:2其中官能团能与H2发生加成反应的有机物结构简式为_____________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图所示。

(1)这种微胶囊吸收CO2的原理是_____________(用离子方程式解释),此过程是_______(填“吸收”或“放出”)能量的过程。
(2)在吸收过程中关于胶囊内溶液下列说法正确的是_____________。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中所有的含碳微粒是CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将吸收的CO2催化加氢可制得乙烯。
已知:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H=-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。
C2H4(g)+4H2O(g)△H=-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。

①根据曲线a计算250℃时该反应的化学平衡常数K=_____________(带入数值列出计算式即可)
②b条件下投料比n(H2)/n(CO2)______3(填“>”、“<”或“=”),判断依据是____________________________
③下列说法正确的是_____________。
a.平衡常数大小:M=M1> N
b.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
c.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
d.工业生产中采取较高温度(250 ℃左右)是为了提高催化剂活性加快反应速率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com