
【题目】下列试剂能用于鉴别甲烷和乙烯的是( )
A.溴水B.碳酸钠溶液C.酒精溶液D.四氯化碳
科目:高中化学 来源: 题型:
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
【答案】(1)H2SO3 (2)①2SO2+O2![]() 2SO3
2SO3
②使SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
【解析】
(1)观察第三组可知,第二组中X物质应该属于硫呈+4价的含氧酸,即亚硫酸
(2)①SO2在V2O5的催化作用下可被氧化为SO3
②由所给数据可知SO3在冰水中呈固态,所以II装置是通过冷凝将混合气体分离
SO2可将酸性KMnO4中的锰元素还原,且有酸生成(溶液pH降低),故反应方程式为:5SO2+ 2H2O + 2MnO4-="=" 5SO42-+ 2Mn2++ 4H+
③SO2与NaOH溶液反应与两者的物质的量比有关:
SO2+ 2NaOH = Na2SO3+ H2O SO2+ NaOH =NaHSO3
现两者的物质的量比为4:7,直接由总方程式根据元素守恒来配平即可
【题型】实验题
【结束】
29
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g)'ΔH=-92.4 kJ·mol-1,NH3在平衡混合气中的体积分数(φ)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
2NH3(g)'ΔH=-92.4 kJ·mol-1,NH3在平衡混合气中的体积分数(φ)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
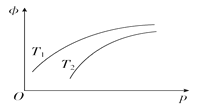
A. T1大于T2
B. 升高温度,该反应的化学平衡常数增大
C. 当n(N2)∶n(H2)∶n(NH3)=1∶3∶2时,反应一定达到平衡状态
D. 其他条件不变,缩小体积增大压强,可提高单位时间内NH3的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1 )判断该反应达到平衡状态的标志是___________(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率=_______________;②达到平衡时反应放出的热量为____________kJ;③此温度下该反应的平衡常数K=__________。
(3)右图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
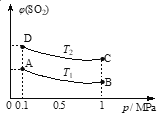
①温度关系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA_________KB,KA_________KD。
查看答案和解析>>
科目:高中化学 来源: 题型:
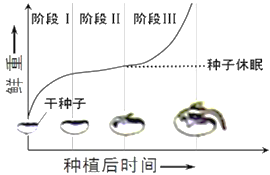
【题目】植物种子本身是非常好的实验材料,回答下面相关问题:
I.蓖麻种子的胚乳呈白色,脂肪含量为种子的70%。为探究该植物种子萌发过程中的物质变化,某研究小组将种子置于温度、水分(蒸馏水)、通气等条件适宜的黑暗环境中培养,定期检查萌发种子(含幼苗)的脂肪、蔗糖、葡萄糖的含量和干重,结果如图所示。回答下列问题:

(1)据甲图分析,萌发过程中胚乳组织中的脂肪酶催化脂肪水解成甘油、脂肪酸,并转变为______________作为胚生长和呼吸消耗的原料。
(2)蓖麻种子中脂肪含量较高,脂肪是脂质的一种,除此外,常见的脂质还有_____和固醇,其中固醇类物质包括胆固醇、_______、_______。胆固醇的作用是_______________。
(3)据乙图可知,蓖麻种子萌发初期时干重增加,导致萌发种子干种增加的主要元素是___________。 第7天至第10天萌发种子(含幼苗)的干重变化趋势是__________,原因是幼苗不能进行光合作用,呼吸作用消耗有机物超过脂肪转化增加的有机物。
II. 大豆种子萌发过程,干重和鲜重均发生变化,鲜重的变化曲线如图,图中阶段______种子胚细胞中自由水的含量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
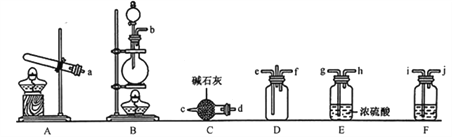
①利用装置A制取实验所需的氨气,写出反应的化学方程式:_______________________。
②该实验中用浓盐酸与MnO2反应制取所需氯气,则装罝F中的试剂是_______________(填写试剂名称)。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:________→-ef←_________(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要___________。
(2)岩脑砂中元素的测定:准确称取a g岩脑砂,与足量的氧化铜混合加热(发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元索和氯元素的质量之比。
3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元索和氯元素的质量之比。
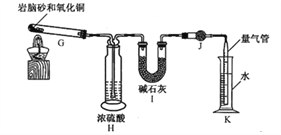
①设置装置H的目的是_____________。
②若装置Ⅰ增重b g,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5 L·mol-1),则岩脑砂中m(N):m(Cl)=_____________(用含b、V的代数式表示,不必化简)。
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值_____________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有机物之间的转化关系。
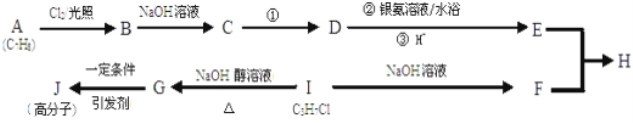
已知:E属于芳香族化合物;F的核磁共振氢谱为三组峰,且面积比为6:1:1。
请回答下列问题:
(1)B的结构简式为__________。F的名称为__________,
(2)C中官能团的名称为__________,G→J的反应类型__________,发生反应①的条件是_______________。
(3)反应B→C的化学方程式为__________。
(4)E的一种同系物X比E的相对分子质量大14;X同分异构体有很多种。
①若X的同分异构体为芳香族化合物,它与E具有相同的官能团,则符合此条件的X的同分异构体有__________种。
②若X的同分异构体能与新制氢氧化铜悬浊液反应,生成砖红色沉淀,也能使FeCl3溶液显紫色,且苯环上的一元取代物有两种,则X的这种同分异构体的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com