
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反 |
| D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(1)(3)(4)(7)(8) | B.(1)(2)(5)(7)(9) |
| C.(1)(2)(5)(7)(9) | D.(1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
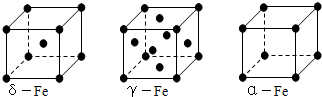
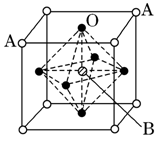
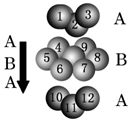
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | b | c | d | | |
| | e | | | | | | | | | | | f | | g | | | |
| | | | | | | | | h | I | | | | | | | | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
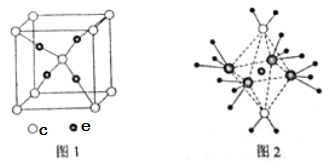
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com