
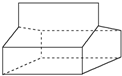
| A. | 篮烷的分子式为C12H12 | |
| B. | 篮烷分子中存在3个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有5种同分异构体 |
分析 A、交点为C原子,交点之间的短线是化学键,利用H原子饱和碳的四价结构,据此书写分子式;
B、交点为C原子,根据分子结构中环中含有的碳原子数目,进行判断;
C、交点为C原子,根据分子结构中环中含有的碳原子数目,进行判断;
D、该分子属于高度对称结构,根据对称性判断分子中等效H原子数目,有几种H原子,其一氯代物就有几种异构体.
解答 解:A、由蓝烷的结构可知,分子中含有12个C原子、14个H原子,分子式为C12H14,故A错误;
B、由蓝烷的结构可知,有如图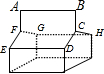 所示的ABCDEF、ABCHGF、CDEFGH 3个六元环,故B正确;
所示的ABCDEF、ABCHGF、CDEFGH 3个六元环,故B正确;
C、由蓝烷的结构可知,有如图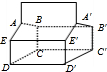 所示的ABCDE、与A′B′C′D′E′2个五元环,故C错误;
所示的ABCDE、与A′B′C′D′E′2个五元环,故C错误;
D、该分子属于高度对称结构,有如图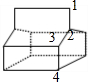 所示的4种H原子,故其一氯代物就有4种同分异构体,故D错误;
所示的4种H原子,故其一氯代物就有4种同分异构体,故D错误;
故选B.
点评 本题考查有机物的结构、同分异构体等,题目难度中等,实际是键线式结构,注意对结构的仔细观察,侧重于考查学士的分析能力.


科目:高中化学 来源: 题型:选择题
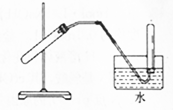
| A. | 用浓硫酸和铜制取二氧化硫 | B. | 用锌粒与稀硫酸反应制取氢气 | ||
| C. | 用氯化铵与氢氧化钙反应制取氨气 | D. | 用铜与浓硝酸反应制取二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
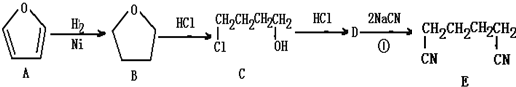
| A. | A→B的反应属于加成反应 | B. | B→C的反应属于酯化反应 | ||
| C. | C→D的反应属于消去反应 | D. | D→E的反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
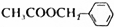 )是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
)是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
 .
. ,名称为苯甲醇.
,名称为苯甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极发生还原反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ | |
| D. | 电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 增大反应物浓度、提高反应物温度都能增大反应速率 | |
| D. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成nmolA的同时生成3nmol的B | |
| C. | A,B,C三种物质的浓度相等 | |
| D. | A,B,C的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com