
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
分析 A、绿色化学的核心是提高原子利用率,减少污染;
B、白色污染是指聚乙烯塑料袋;
C、煤经液化能变为甲醇;
D、明矾在水溶液中能水解为氢氧化铝胶体.
解答 解:A、绿色化学的核心是提高原子利用率,减少污染,而非造成污染后再治理,故A错误;
B、白色污染是指聚乙烯塑料袋,由于不能降解从而对环境造成污染,但用CO2合成的是可降解的聚碳酸酯塑料,故可以减少白色污染和危害,故B正确;
C、煤经液化能变为甲醇,燃烧仍生成二氧化碳,故不能减少二氧化碳的排放,故C错误;
D、明矾在水溶液中能水解为氢氧化铝胶体,有吸附作用,故能净水,但不能杀菌消毒,故D错误.
故选B.
点评 本题考查了绿色化学的概念、环境的保护和明矾的净水原理等,难度不大,应注意的是明矾只能净水不能消毒.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和H2SO4 | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2属于酯的同分异构体 | B. | C5H10O2属于酸的同分异构体 | ||
| C. | 甲苯的一氯取代物 | D. | 化合物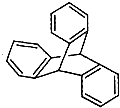 的一氯取代物 的一氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:
对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol•L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 水电离出的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、SO32- | |
| C. | 使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| D. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com