
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是
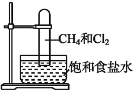
A. 此反应无光照也可发生
B. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4和Cl2完全反应后液面上升,液体充满试管
【答案】C
【解析】
甲烷与氯气在光照条件下发生取代反应,反应产物有一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳四种卤代烃,同时还有氯化氢生成,所以反应产物为混合物;卤代烃不溶于水中,因此在试管内壁有油状液滴出现,据此进行判断。
A、甲烷和氯气发生取代反应,必须在光照条件下进行,故A错误;
B、甲烷和Cl2反应后生成的CH3Cl能继续和氯气发生取代,从而生成二氯甲烷、三氯甲烷和四氯化碳,故B错误;
C、发生取代反应生成的HCl溶于氯化钠溶液后,能使氯化钠的溶解度降低,故饱和氯化钠溶液中有晶体析出,所以C选项是正确的;
D、甲烷和氯气取代后生成的一氯甲烷为气体,其它有机产物均为液态,生成的HCl易溶于水,故甲烷和氯气的反应为气体的物质的量减少的反应,故会导致液面上升,但液体不能充满整个试管,故D错误。
所以C选项是正确的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)△H<0。测得v正(SO2)随反应时间(t)的变化如图所示,其中在t2时改变了某个条件。下列有关说法正确的是( )

A. t2时改变的条件可能是:升温或缩小容器体积
B. t1时平衡常数K1小于t3时平衡常数K2
C. t1时平衡混合气的![]() > t3时平衡混合气的
> t3时平衡混合气的![]()
D. t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
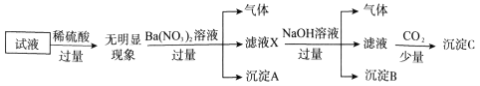
下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是_______________。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2kJ/mol
SO2(g)+CaO(s)==CaSO3(s) △H=-402kJ/mol
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式_________________________________。
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2 和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol
N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H=-64.2kJ/mol
N2(g)+2CO2(g) △H=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0. 58 | 0. 40 | 0. 40 | 0. 48 | 0. 48 |
N2 | 0 | 0. 21 | 0.30 | 0. 30 | 0. 36 | 0. 36 |
①0~10min内,NO的平均反应速率v(NO)=_____,当升高反应温度,该反应的平衡常数K____________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_________(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)某实验室模拟反应b,在密闭容器中加入足量的C 和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图
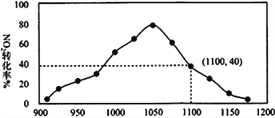
请从动力学角度分析,1050 kPa 前,反应b 中NO2转化率随着压强增大而增大的原因____________;在1100 kPa时,NO2的体积分数为_________________________。
(5)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(p分)=气体总压(p总)× 体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 葡萄糖的燃烧热是2800 kJ/mol,则![]()
B. 已知2C(s)+O2(g)===2CO(g)ΔH=-221 kJ/mol,则该反应的反应热为221 kJ·mol-1
C. 已知稀溶液中,H+ (aq)+OH- (aq)===H2O(l)ΔH=-57.3 kJ·mol-1 ,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
D. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的叙述正确的是
A.金属钠可以保存在无水酒精中
B.受热时碳酸氢钠比碳酸钠稳定
C.过氧化钠可用作呼吸面具的供氧剂
D.不能用玻璃瓶盛放稀氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)氨的催化氧化反应:4 NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H< 0,是制硝酸的基础反应,在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
第0 min | 0.8 | 1.6 | 0 |
第1 min | a | 1.35 | 0.2 |
第2 min | 0.3 | 0.975 | 0.5 |
第3 min | 0.3 | 0.975 | 0.5 |
第4 min | 0.7 | 1.475 | 0.1 |
①反应在第1min到第2min时,NH3的平均反应速率为______________。
②反应在第3 min时改变了条件,改变的条件可能是___________(填序号)。
A.使用催化剂 B.减小压强 C.升高温度 D.增加O2的浓度
③说明4NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
4NO(g)+6 H2O(g)达到平衡状态的是____(填序号)。
A.单位时间内生成n mol NO的同时生成n mol NH3
B.百分含量w(NH3)=w(NO)
C.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
D.在恒温恒容的容器中,混合气体的平均相对分子质量不再变化
(2)若在容积为2L的密闭容器中充入4.0molNH3(g)和5.0molO2(g),发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
4NO(g)+6H2O(g),保持其他条件不变,在相同的时间内测得c(NO)与温度的关系如下图1所示。则 T1℃下,NH3的平衡转化率为______。
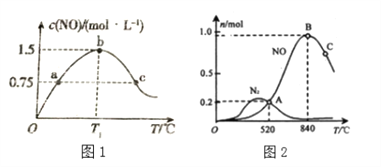
(3)氨催化氧化时会发生两个竞争反应,分别为
反应I:4NH![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1。
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如上图2:
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②C点比B点所产生的NO的物质的量少的主要原因______________________________。(4)通过以上两个竞争反应写出NO分解生成N2与O2的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分散系存在比较广泛,日常生活中常见的烟、雾、碘酒、食盐水等都是分散系,关于这四种分散系的分散质和分散剂的说法中,正确的是( )
分散系 | 分散质 | 分散剂 | |
A | 烟 | 微小水滴 | 空气 |
B | 雾 | 微小尘埃 | 空气 |
C | 碘酒 | 碘 | 酒精 |
D | 食盐水 | 水 | 氯化钠 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com