
 ,故答案为:
,故答案为: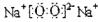 ;
;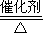 4NO+6H2O,
4NO+6H2O,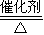 4NO+6H2O;
4NO+6H2O;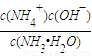 =
=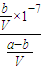 =
=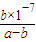 (假定混合后溶液的体积为V),
(假定混合后溶液的体积为V),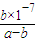 ;
;

科目:高中化学 来源: 题型:
| 1 | 2 |
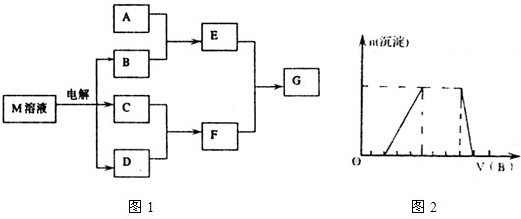
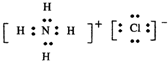
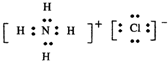
查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| △ |
| ||
| △ |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
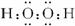
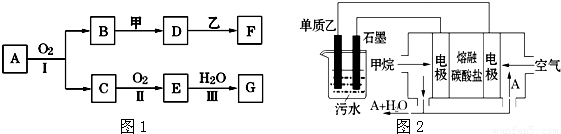
图1-3-15
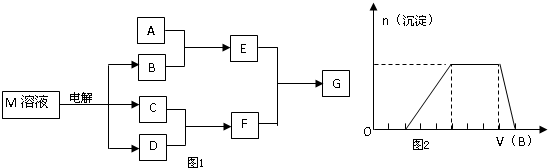
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________。
(2)A、B、H的化学式:A___________、B___________、H___________。
(3)①H2O2分子的电子式:____________。
②写出C的酸性溶液与双氧水反应的离子方程式:______________________。
(4)写出鉴定E中阳离子的实验方法和现象:
____________________________________________________________________。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com