
ЎҫМвДҝЎҝТ»¶ЁОВ¶ИПВЈ¬ФЪИэёцМе»эҫщОӘ2.0LөДәгИЭГЬұХИЭЖчЦР·ЦұрјУИлТ»¶ЁБҝөДXЈ¬·ўЙъ·ҙУҰЈәpX(g) ![]() Y(g)+Z(g)Ј¬Па№ШКэҫЭИзПВұнЛщКҫЈә
Y(g)+Z(g)Ј¬Па№ШКэҫЭИзПВұнЛщКҫЈә
ИЭЖчұаәЕ | ОВ¶И(Ўж) | ЖрКјОпЦКөДБҝ(mol) | ЖҪәвОпЦКөДБҝ(mol) | |
X(g) | Y(g) | Z(g) | ||
ўс | 387 | 0.20 | 0.080 | 0.080 |
ўт | 387 | 0.40 | 0.160 | 0.160 |
ўу | T | 0.20 | 0.090 | 0.090 |
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ИфИЭЖчўсЦР·ҙУҰҫӯ10minҙпөҪЖҪәвЈ¬ФтЗ°10minДЪYөДЖҪҫщ·ҙУҰЛЩВКv(Y)=___________ЎЈИЭЖчўсәНИЭЖчўтЦРЖрКјКұXөД·ҙУҰЛЩВКv(X)ўс___________v(X)ўт(МоЎ°ҙуУЪЎұЎ°РЎУЪЎұ»тЎ°өИУЪЎұ)ЎЈ
ЈЁ2Ј©ТСЦӘёГХэ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ФтT___________387(МоЎ°ҙуУЪЎұ»тЎ°РЎУЪЎұ)Ј¬ЕР¶ПАнУЙКЗ___________ЎЈ
ЈЁ3Ј©·ҙУҰ·ҪіМКҪЦРXөД»ҜС§јЖБҝКэpөДИЎЦөОӘ___________Ј¬ИЭЖчўтЦРXөДЖҪәвЧӘ»ҜВКОӘ___________ЎЈИфЖрКјКұПтИЭЖчўсЦРідИл0.1molXЎў0.15molYәН0.10molZЈ¬Фт·ҙУҰҪ«Пт___________ (МоЎ°ХэЎұ»тЎ°ДжЎұ)·ҙУҰ·ҪПтҪшРРЈ¬ЕР¶ПАнУЙКЗ_____________________________________________________ЎЈ
Ўҫҙр°ёЎҝ 0.0040mol/(LЎӨmin) РЎУЪ РЎУЪ Па¶ФУЪИЭЖчўсЈ¬ИЭЖчўуЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬јҙҪөөНОВ¶И(»тХэ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ЖҪәвПт·ЕИИ·ҙУҰ·ҪПтТЖ¶ҜЈ¬№КОВ¶ИҪөөН) 2 80% Хэ ёщҫЭИЭЖчўсЦРКэҫЭҝЙјЖЛгөГөҪ387ЎжёГ·ҙУҰөДЖҪәвіЈКэОӘ4Ј¬ 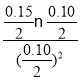 =1.5<4Ј¬ЛщТФ·ҙУҰПтХэ·ҙУҰ·ҪПтҪшРР
=1.5<4Ј¬ЛщТФ·ҙУҰПтХэ·ҙУҰ·ҪПтҪшРР
ЎҫҪвОцЎҝКФМв·ЦОцЈәұҫМвҝјІй»ҜС§·ҙУҰЛЩВКәН»ҜС§ЖҪәвөДјЖЛгЈ¬ОВ¶ИЎўС№Зҝ¶Ф»ҜС§ЖҪәвөДУ°ПмЈ¬»ҜС§ЖҪәвіЈКэөДУҰУГЎЈ
ЈЁ1Ј©ИЭЖчIЦРҰФЈЁYЈ©=![]() =0.0040mol/ЈЁLЎӨminЈ©ЎЈИЭЖчIәНИЭЖчIIОВ¶ИПаН¬Ј¬ИЭЖчIIЦРXөДЖрКјЕЁ¶ИОӘИЭЖчIЦРөДБҪұ¶Ј¬ФтЖрКј·ҙУҰЛЩВКҰФЈЁXЈ©IРЎУЪҰФЈЁXЈ©IIЎЈ
=0.0040mol/ЈЁLЎӨminЈ©ЎЈИЭЖчIәНИЭЖчIIОВ¶ИПаН¬Ј¬ИЭЖчIIЦРXөДЖрКјЕЁ¶ИОӘИЭЖчIЦРөДБҪұ¶Ј¬ФтЖрКј·ҙУҰЛЩВКҰФЈЁXЈ©IРЎУЪҰФЈЁXЈ©IIЎЈ
ЈЁ2Ј©ёГ·ҙУҰөДХэ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ЙэёЯОВ¶ИЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ»ИЭЖчIәНИЭЖчIIIОВ¶ИІ»Н¬Ј¬XЖрКјОпЦКөДБҝПаН¬Ј¬ЖҪәвКұИЭЖчIIIЦРYЎўZОпЦКөДБҝҙуУЪИЭЖчIЦРЈ¬ИЭЖчIIIПа¶ФУЪИЭЖчIЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ФтTРЎУЪ387ЎЈ
ЈЁ3Ј©ИЭЖчIIәНИЭЖчIОВ¶ИПаН¬Ј¬ИЭЖчIIЦРXЖрКјОпЦКөДБҝОӘИЭЖчIЦРөДБҪұ¶Ј¬ИЭЖчIIПаөұУЪФЪИЭЖчI»щҙЎЙПҪ«Ме»эЛхРЎОӘФӯАҙөДТ»°лЈ¬ЖҪәвКұИЭЖчIIЦРYЎўZОпЦКөДБҝОӘИЭЖчIЦРөДБҪұ¶Ј¬јҙФцҙуС№ЗҝЈ¬ЖҪәвІ»ТЖ¶ҜЈ¬Фтp=1+1=2ЎЈ·ҙУҰөД·ҪіМКҪОӘ2XЈЁgЈ©![]() YЈЁgЈ©+ZЈЁgЈ©Ј¬ФтИЭЖчIIЙъіЙ0.160molYПыәД0.320molXЈ¬ИЭЖчIIЦРXөДЖҪәвЧӘ»ҜВКОӘ
YЈЁgЈ©+ZЈЁgЈ©Ј¬ФтИЭЖчIIЙъіЙ0.160molYПыәД0.320molXЈ¬ИЭЖчIIЦРXөДЖҪәвЧӘ»ҜВКОӘ![]() 100%=80%ЎЈИЭЖчIЦРЙъіЙ0.080molYПыәД0.160molXЈ¬ИЭЖчIЖҪәвКұXЎўYЎўZОпЦКөДБҝТАҙООӘ0.04molЎў0.08molЎў0.08molЈ¬ЖҪәвКұXЎўYЎўZОпЦКөДБҝЕЁ¶ИТАҙООӘ0.02mol/LЎў0.04mol/LЎў0.04mol/LЈ¬387ЎжКұ·ҙУҰөД»ҜС§ЖҪәвіЈКэK=
100%=80%ЎЈИЭЖчIЦРЙъіЙ0.080molYПыәД0.160molXЈ¬ИЭЖчIЖҪәвКұXЎўYЎўZОпЦКөДБҝТАҙООӘ0.04molЎў0.08molЎў0.08molЈ¬ЖҪәвКұXЎўYЎўZОпЦКөДБҝЕЁ¶ИТАҙООӘ0.02mol/LЎў0.04mol/LЎў0.04mol/LЈ¬387ЎжКұ·ҙУҰөД»ҜС§ЖҪәвіЈКэK=![]() =4Ј¬ҙЛКұөДЕЁ¶ИЙМОӘ
=4Ј¬ҙЛКұөДЕЁ¶ИЙМОӘ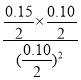 =1.5<4Ј¬ЛщТФ·ҙУҰПтХэ·ҙУҰ·ҪПтҪшРРЎЈ
=1.5<4Ј¬ЛщТФ·ҙУҰПтХэ·ҙУҰ·ҪПтҪшРРЎЈ


 Н¬ІҪБ·П°Зҝ»ҜНШХ№ПөБРҙр°ё
Н¬ІҪБ·П°Зҝ»ҜНШХ№ПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘЈәHCN(aq)УлNaOH(aq)·ҙУҰөДЎчH=Јӯ12.1kJ /molЈ»HCl(aq)УлNaOH(aq)·ҙУҰөДЎчH =Јӯ55.6kJ/ molЎЈФтHCNФЪЛ®ИЬТәЦРөзАлөДҰӨHөИУЪ
A. Јӯ67.7 kJ /mol B. Јӯ43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪМе»э№М¶ЁөДГЬұХИЭЖчЦРҪшРРҝЙДж·ҙУҰ2NO2![]() 2NO+O2Ј¬ПВБРДЬЧчОӘ·ҙУҰҙпөҪЖҪәвЧҙМ¬ұкЦҫөДКЗ( )
2NO+O2Ј¬ПВБРДЬЧчОӘ·ҙУҰҙпөҪЖҪәвЧҙМ¬ұкЦҫөДКЗ( )
ўЩөҘО»КұјдДЪЙъіЙnmol O2өДН¬КұЙъіЙ2n mol NO2
ўЪөҘО»КұјдДЪЙъіЙn mol O2 өДН¬КұЙъіЙ2n mol NO
ўЫУГNO2 ЎўNOЎўO2ұнКҫөД·ҙУҰЛЩВКЦ®ұИОӘ2ЎГ2ЎГ1
ўЬ»мәПЖшМеөДСХЙ«І»ФЩёДұд ўЭ»мәПЖшМеөДГЬ¶ИІ»ФЩёДұд
ўЮ»мәПЖшМеөДС№ЗҝІ»ФЩёДұд ўЯ»мәПЖшМеөДЖҪҫщПа¶Ф·ЦЧУЦКБҝІ»ФЩёДұд
AЈ®ўЩўЬўЮўЯ BЈ®ўЪўЫўЭўЯ CЈ®ўЩўЫўЬўЭ DЈ®И«Іҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіЈОВПВЈ¬H3AsO4ИЬТәЦРёчә¬ЙйБЈЧУ·ЦІј·ЦКэ(ЖҪәвКұёГБЈЧУөДЕЁ¶ИУлёчә¬ЙйБЈЧУЕЁ¶ИЦ®әНөДұИ)УлpHөД№ШПөИзУТНјЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ
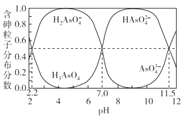
A. H3AsO4өДөЪТ»ІҪөзАліЈКэKa1>0.01
B. pH=7.0КұЈ®ИЬТәЦРc(AsO43-)=c(H3AsO4)=0
C. 0.1molЎӨL-1H3AsO4ИЬТәөДpH<2
D. pH=12КұЈ¬c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіИ»ЁҙјҫЯУРГө№еј°Ж»№ыПгЖшЈ¬ҝЙЧчОӘПгБПЈ¬ЖдҪб№№јтКҪИзПВЈә
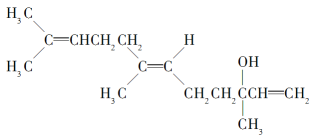
ПВБР№ШУЪіИ»ЁҙјөДРрКцЈ¬ҙнОуөДКЗ(ЎЎЎЎ)
A. јИДЬ·ўЙъИЎҙъ·ҙУҰЈ¬ТІДЬ·ўЙъјУіЙ·ҙУҰ
B. ФЪЕЁБтЛбҙЯ»ҜПВјУИИНСЛ®Ј¬ҝЙЙъіЙІ»Ц№Т»ЦЦЛДП©Мю(·ЦЧУЦРә¬УРЛДёцМјМјЛ«јьөДП©Мю)
C. 1 molіИ»ЁҙјФЪСхЖшЦРід·ЦИјЙХЈ¬РиПыәД470.4 LСхЖш(ұкЧјЧҙҝц)
D. 1 molіИ»ЁҙјФЪКТОВПВУлдеөДЛДВИ»ҜМјИЬТә·ҙУҰЈ¬Чо¶аПыәД240 g Br2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜС§РЛИӨРЎЧй¶ФТ»ЦЦ·ПҫЙәПҪр(ә¬УРCuЎўFeЎўSiөИФӘЛШ)ҪшРР·ЦАлЎў»ШКХФЩАыУГЈ¬ЛщЙијЖ№ӨТХБчіМИзПВЎЈ
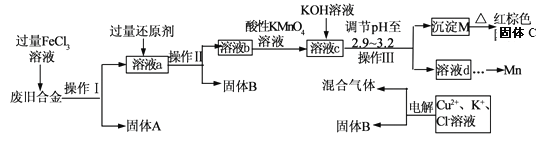
ТСЦӘ:298KКұЈ¬Ksp[Fe(OH)3]=4.0ЎБ10ЎӘ38Ј¬Ksp[Cu(OH)2]=2.2ЎБ10Т»20Ј¬
Ksp[Mn(OH)2]=1.9ЎБ10ЎӘ13
»ШҙрПВБРОКМв:
(1)ІЩЧчIЎўўтЎўўуОӘ________Ј¬№ММеBОӘ_________ (Мо»ҜС§КҪ)ЎЈ
(2)јУИЛ№эБҝFeCl3ИЬТә№эіМЦРУлҪПІ»»оЖГөДҪрКф·ҙУҰөДАлЧУ·ҪіМКҪ__________________ЎЈ
(3)өчҪЪpHЦБ2.9Ў«3.2өДДҝөДКЗ·ЦАл_________ (МоАлЧУ·ыәЕ)
(4)ўЩПтИЬТәbЦРјУИлЛбРФKMnO4ИЬТә·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ_________________ЎЈ
ўЪИфУГ a mol/LKMnO4ИЬТәҙҰАнИЬТәbЈ¬өұЗЎәГ·ҙУҰКұПыәДKMnO4ИЬТәV mLЈ¬ЛщөГәмЧШЙ«№ММеCөДОпЦКөДБҝОӘ_________(УГә¬aЎўvөДҙъКэКҪұнКҫ)
(5)іЈОВПВЈ¬ИфИЬТәcЦРЛщә¬өДҪрКфСфАлЧУЕЁ¶ИПаөИЈ¬ПтИЬТәcЦРЦрөОјУИлKOHИЬТәЈ¬ЧоәуЙъіЙөДіБөнОӘ_________ (Мо»ҜС§КҪ)ЎЈ
(6)УГ¶иРФөзј«өзҪвКұСфј«ІъЙъұкЧјЧҙҝцПВөДЖшМе6.72LЈ¬Тхј«өГөҪөДөзЧУКэОӘ0.8NAЈ¬ФтЙъіЙСхЖшөДОпЦКөДБҝОӘ________ mol.
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіэИҘГҫ·ЫЦР»мУРөДЙЩБҝВБ·ЫЈ¬ҝЙСЎУГөДКФјБКЗЈЁ Ј©
A.СОЛб
B.NaOHИЬТә
C.ПхЛб
D.КіСОЛ®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРёчЧйКэҫЭЦРЈ¬З°ХЯёХәГКЗәуХЯБҪұ¶өДКЗ
A. 2 molЛ®өДДҰ¶ыЦКБҝәН1 molЛ®өДДҰ¶ыЦКБҝ
B. 200 mL 1 molЎӨLЈӯ1ВИ»ҜёЖИЬТәЦРc(ClЈӯ)әН100 mL 2 molЎӨLЈӯ1ВИ»ҜјШИЬТәЦРc(ClЈӯ)
C. ұкЧјЧҙҝцПВЈ¬22.4 LТ»Сх»ҜМјЦРСхФӯЧУКэәН16 g¶юСх»ҜБтЦРСхФӯЧУКэ
D. 2 molЎӨLЈӯ1H2SO4ИЬТәЦРөДHЈ«ёцКэУл1 molЎӨLЈӯ1HClИЬТәЦРөДHЈ«ёцКэ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ°ұЖшУР№г·әУГНҫЈ¬№ӨТөЙПАыУГ·ҙУҰN2(g)+3H2(g)![]() 2NH3(g) H<0әПіЙ°ұЈ¬»ШҙрТФПВОКМвЈә
2NH3(g) H<0әПіЙ°ұЈ¬»ШҙрТФПВОКМвЈә
ЈЁ1Ј©ДіРЎЧйОӘБЛМҪҫҝНвҪзМхјю¶Ф·ҙУҰөДУ°ПмЈ¬ТФc0 mol/L H2ІОјУәПіЙ°ұ·ҙУҰЈ¬ФЪaЎўbБҪЦЦМхјюПВ·ЦұрҙпөҪЖҪәвЈ¬ИзНјAЎЈ
ўЩaМхјюПВЈ¬0Ў«t0өДЖҪҫщ·ҙУҰЛЩВКv(H2)=_____________molЎӨL-1ЎӨmin-1ЎЈ
ўЪПа¶Фa¶шСФЈ¬bҝЙДЬёДұдөДМхјюКЗ________________ЎЈ
ўЫФЪaМхјюПВt1КұҝМҪ«ИЭЖчМе»эС№ЛхЦБФӯАҙөД1/2Ј¬t2КұҝМЦШРВҪЁБўЖҪәвЧҙМ¬ЎЈЗлФЪҙрМвҝЁПаУҰО»ЦГ»ӯіцt1КұҝМәуc(H2)өДұд»ҜЗъПЯІўЧчПаУҰөДұкЧўЎЈ_____________
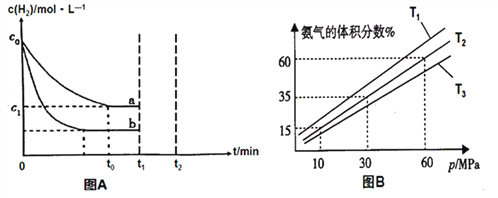
ЈЁ2Ј©ДіРЎЧйНщТ»әгОВәгС№ИЭЖчідИл9mol N2әН23mol H2ДЈДвәПіЙ°ұ·ҙУҰЈ¬НјBОӘІ»Н¬ОВ¶ИПВЖҪәв»мәПОпЦР°ұЖшөДМе»э·ЦКэУлЧЬС№ЗҝЈЁpЈ©өД№ШПөНјЎЈ
ўЩ ұИҪПT1ЎўT3өДҙуРЎT1__________T3ЈЁМоЎ°<Ўұ»тЎ°>ЎұЈ©ЎЈ
ўЪ·ЦОцМеПөФЪT2Ўў60MPaПВҙпөҪөДЖҪәвЈ¬ҙЛКұN2өДЖҪәв·ЦС№ОӘ_______MPaЈЁ·ЦС№ЈҪЧЬС№ЎБОпЦКөДБҝ·ЦКэЈ©Ј»БРКҪұнКҫҙЛКұөДЖҪәвіЈКэKp=______________ЎЈЈЁУГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИЈ¬І»ТӘЗујЖЛгҪб№ыЈ©
ЈЁ3Ј©УРИЛАыУГNO2әНNH3№№іЙөзіШөД·Ҫ·ЁЈ¬јИДЬКөПЦУРР§ПыіэөӘСх»ҜОпөДЕЕ·ЕјхЙЩ»·ҫіОЫИҫЈ¬УЦДЬід·ЦАыУГ»ҜС§ДЬҪшРРҙЦНӯҫ«Б¶Ј¬ИзНјCЛщКҫЈ¬dј«ОӘҙЦНӯЎЈ
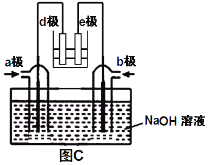
ўЩ aј«НЁИл________(Мо»ҜС§КҪ)Ј»
ўЪ bј«өзј«·ҙУҰОӘ_____________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com