
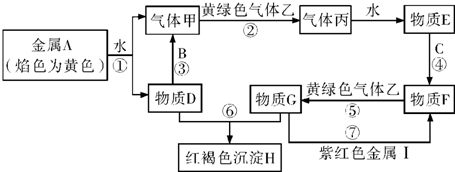
分析 金属单质A的焰色反应为黄色,则A为Na,与水反应生成的气体甲为H2,D为NaOH,黄绿色气体乙为Cl2,则丙为HCl,E为盐酸,金属B能与NaOH反应生成氢气,则B为Al,C是地壳中含量排第二的金属,则C为Fe,与盐酸反应生成F为FeCl2 ,F与氯气反应得到G为FeCl3,G与氢氧化钠反应得到红褐色沉淀H为Fe(OH)3,I为紫红色金属,与氯化铁反应得到氯化亚铁,则I为Cu,据此解答.
解答 解:金属单质A的焰色反应为黄色,则A为Na,与水反应生成的气体甲为H2,D为NaOH,黄绿色气体乙为Cl2,则丙为HCl,E为盐酸,金属B能与NaOH反应生成氢气,则B为Al,C是地壳中含量排第二的金属,则C为Fe,与盐酸反应生成F为FeCl2 ,F与氯气反应得到G为FeCl3,G与氢氧化钠反应得到红褐色沉淀H为Fe(OH)3,I为紫红色金属,与氯化铁反应得到氯化亚铁,则I为Cu.
(1)由上述分析可知,C为Fe,H为Fe(OH)3,故答案为:Fe;Fe(OH)3;
(2)由上述分析可知,甲为氢气,乙为氯气,故答案为:氢气;氯气;
(3)反应①的离子方程式:2Na+2H2O=2Na++2OH-+H2↑;反应⑦的离子方程式:2Fe3++Cu=2Fe2++Cu2,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Fe3++Cu=2Fe2++Cu2+;
(4)实验室检验物质FeCl3中阳离子的常用试剂是:KSCN溶液,证明存在该阳离子的现象是:溶液变为血红色,
故答案为:KSCN溶液;溶液变为血红色.
点评 本题是考查无机物推断,难度中等,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
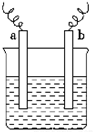 如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )
如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )| A. | 该装置一定是原电池 | |
| B. | a极上一定发生还原反应 | |
| C. | a、b可以是同种电极材料 | |
| D. | 该过程中能量的转换可以是电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质在反应中失去电子,该物质是氧化剂 | |
| B. | 置换反应一定属于氧化还原反应 | |
| C. | 氧化还原反应的本质是元素化合价的升降 | |
| D. | 发生反应时,电子不可以在同种元素间转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2n mol X,同时消耗nmol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 容器内气体的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com