
【题目】下列说法不正确的是
A.化学电池的反应基础是氧化还原反应
B.铅蓄电池是二次电池
C.燃料电池是一种高效,但是污染环境的发电装置
D.锌锰干电池是一次性电池
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(化学式为:Na2S2O5):白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体。它是一种化工原料,常用作抗氧化剂。
工业上,常用湿法制作焦亚硫酸钠,湿法制作有三步,其中:
第一步:在饱和碳酸钠溶液中通入足量的SO2,调至PH=4.1,得亚硫酸氢钠;
第二步:……
第三步:……
根据上述内容,回答问题:
(1)焦亚硫酸钠中S的化合价为
(2)第一步化学方程式为:
(3)焦亚硫酸钠含量测定:取焦亚硫酸钠样品约0.15g ,于密封瓶中,加入0.05mol/L碘(I2)滴定液50ml,塞紧,振摇溶解后,加盐酸1ml,用0.1mol/L硫代硫酸钠(Na2S2O3)滴定液滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,用去硫代硫酸钠溶液VmL。并将滴定结果进行空白对比。
已知:每1ml碘滴定液(0.05mol/L)相当于4.750mg的Na2S2O5。
该反应有两个离子方程式,分别为:
a: 3H2O + S2O52- + 2I2 = 2SO42- + 4I- + 6H+
b: 5H2O + S2O32- + 4I2 = 2SO42- + 8I- + 10H+
①a反应中每消耗1mol还原剂转移 mol电子;
②滴定至终点时的判定方法是: ;
③焦亚硫酸钠的质量分数为(列式表示,不计算结果): (可能用到的相对分子质量:Na2S2O5=190)
④由于碘单质在水中溶解度低,因此碘滴定液通常用I2与KI混溶得到碘(KI3)滴定液。取12.7g碘单质和26.6g碘化钾加水50mL溶解后,加盐酸3滴,定容至1000mL。该碘(KI3)滴定液物质的量浓度为 ;该碘(KI3)滴定液与焦亚硫酸钠反应时具有 性(填“氧化”或“还原”)。[可能用到的相对原子质量:I=127、K=39]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
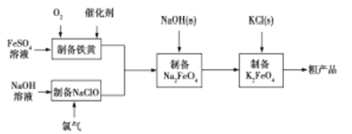
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式 。
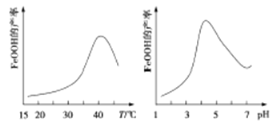
(2)制备铁黄的反应中氧化剂与还原剂的物质的量之比为 。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择 ;pH大于4.5时铁黄产率降低的主要原因可能是 。
(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3、CN-等,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式 。
(4)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:
2K2FeO4+3Zn+8H2O![]() 2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
(5)已知:常温下,Kap[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)= mol·L-1。
(6)如果上述流程中,铁元素总利用率为75%。利用1mol 2mol·L-1FeSO4溶液能制备纯度为90%的高铁酸钾 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A、Ca2+、Na+、NO3-、CO32- B、Mg2+、C1-、NH4+、SO42-
C、K+、Cl-、HCO3-、NO3- D、Ca2+、Na+、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
元素A、B、C、D、E、F、G在元素周期表中的位置如下图所示,回答下列问题:

(1)G的基态原子核外电子排布式为________。原子的第一电离能:D________E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l > l-b > b-b(l为孤对电子对,b为键合电子对),则关于A2C中的A-C-A键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于________晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为________。
(4)化合物BCF2的立体构型为________,其中B原子的杂化轨道类型是________,写出两个与BCF2具有相同空间构型的含氧酸根离子________。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。每个晶胞中含有___________个E2+,列式计算EC晶体的密度(g·cm-3)______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
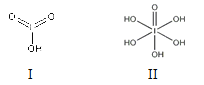
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
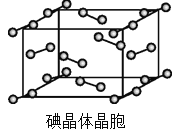
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
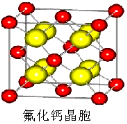
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给出下列氧化还原反应,试回答下列问题。
(1)KMnO4+ KI+ H2SO4 K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式 被还原的元素 ,发生氧化反应的物质 。
(2)3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
用双线桥标出电子转移的方向和数目 氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现 性(填氧化或还原);11molP中被P氧化的P是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示。下列说法错误的是
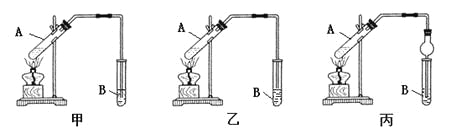
A. 上述实验装置正确且能顺利完成实验的是乙和丙
B. 试管B内盛放的液体是NaOH溶液
C. 在试管A中应加几块碎瓷片以防止A中的液体加热时发生暴沸
D. 反应结束后振荡试管B,B中液体分为两层,上层为无色油状液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com