
下列离子反应方程式正确的是( )
A.在硫酸铝溶液中加入过量氨水:Al3+ + 4OH- = AlO2-+2H2O
B.碳酸氢镁溶液中加入过量石灰水:
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
C.往FeCl3溶液中加入Fe粉:2Fe3+ +Fe =3Fe2+
D.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:填空题
(14分)聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”)。
②如将AlT = 2.520 mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是 。
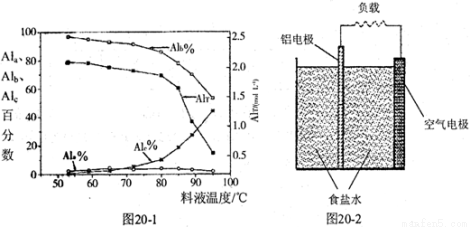
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g)△H1 = a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g)△H2 = b kJ·mol-1
则反应Al2O3(s)+ 3C(s) = 2Al(l)+ +3CO(g)△H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式。
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:实验题
(16分)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为
。
(3)完成煅烧中的化学方程式: CuO + Al2O3  CuAlO2 + ↑
CuAlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
已知:N2(g)+3H2(g) 2NH3(g);△H=-92.4 kJ/mol,下列结论正确的是
2NH3(g);△H=-92.4 kJ/mol,下列结论正确的是
A.在密闭容器中加入1 molN2(g)和3 molH2(g)充分反应放热92.4 kJ
B.N2(g)+3H2(g) 2NH3(l);△H=-Q kJ/mol ,则Q>92.4
2NH3(l);△H=-Q kJ/mol ,则Q>92.4
C.增大压强,平衡向右移动,平衡常数增大
D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60%
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:填空题
(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.胆矾是电解质、液氨是非电解质
B.淀粉溶液、硅酸、氯化铁溶液均为胶体
C.淀粉、纤维素、油脂都属于天然高分子化合物
D.SO3、SiO2、NO2均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:选择题
下列说法正确的是:
A.石油分馏和煤的干馏都是物理变化
B.塑料和蚕丝都是天然高分子化合物
C.淀粉和纤维素水解的最终产物都是葡萄糖
D.易溶于汽油、酒精、苯的物质一定是有机物
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸
D.气态氢化物的稳定性:HmY小于HmX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com