
| A. | NH4+ | B. | NO3- | C. | AlO2- | D. | HCO3- |
分析 室温下,水的离子积为10-14,由水电离生成的H+和OH-的物质的量浓度的乘积为10-24,即c(H+)•c(OH-)=10-24,所以水电离的c(H+)=c(OH-)=10-12,溶液显示酸性或者碱性,据此进行判断.
解答 解:水电离的H+和水电离的OH-一定相等,所以由水电离生成的H+和OH-物质的量浓度的乘积为10-24的溶液中,水电离的H+为10-12,则溶液或呈酸性或呈碱性,
A.铵根离子不能存在于碱性溶液中,故A错误;
B.硝酸根离子既可以存在于酸性溶液,也可以存在碱性溶液中,故B正确;
C.AlO2-不能存在于酸性溶液中,故C错误;
D.碳酸氢根离子既能够与氢离子反应,也能够与氢氧根离子反应,溶液中一定不会存在,故D错误.
故选B.
点评 本题考查了离子共存,题目难度中等,离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+,Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe、H+、NO3-;S2-、ClO-;S2-、Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 取0.5L溶液,Na+的浓度是0.5mol/L | |
| B. | 取0.1L溶液稀释至l L,SO42-离子浓度是0.05 mol/L | |
| C. | 溶质的离子总数是6.02×1023个 | |
| D. | 该溶液是把0.5molNa2SO4溶于1L水中配制而成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
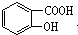 ,请回答下列问题:
,请回答下列问题: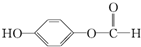 .
. ,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)C;
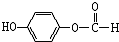
,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)C;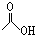 ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: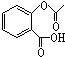 ,则阿斯匹林的分子式为C9H8O4.
,则阿斯匹林的分子式为C9H8O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 16克氧气和16克臭氧中所含原子数均为NA | |
| C. | 1mol氯气被氢氧化钠溶液完全吸收,转移的电子数为2NA | |
| D. | 标准状况下,44.8L水中所含的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abdi | B. | cefk | C. | fghl | D. | bcegj |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2Al+6H+=2Al3++3H2↑可知2Fe+6H+═2Fe3++3H2↑ | |
| B. | 由Na与水反应可知2Al+6H2O═2Al(0H)3+3H2↑ | |
| C. | 由Na2O为碱性氧化物,Al2O3为两性氧化物可知,Fe2O3为酸性氧化物 | |
| D. | 由Na不能从CuSO4溶液置换出Cu可知,K也不能与FeCl3溶液反应置换出Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未润洗就装标准液滴定 | |
| B. | 锥形瓶未用待测液润洗 | |
| C. | 滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失 | |
| D. | 读取标准液读数时,滴前仰视,滴定到终点后俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1 L 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 等V、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com