
 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.分析 (1)基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3;和砷位于同一周期,且未成对电子数也相同的元素,它们的外围电子排布式为:3d34s2、3d74s2;
(2)在元素周期表中,同周期中从左向右,元素的非金属性增强,电负性增强,同主族元素从上向下,元素的非金属性减弱,电负性减弱;
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物范德华力强,沸点高;
(4)P4分子为正四面体构型,P4分子中P原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4;依据相似相溶的原理进行解答;
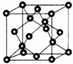
(5)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,由化学式可知晶胞中As数目占原子总数的$\frac{1}{2}$;
(6)计算晶胞的体积和质量,根据密度$ρ=\frac{m}{V}$计算.
解答 解:(1)基态As原子核外电子排布式为1s22s22p63s23p63d104s24p3,含有4个能层,最高能级的电子排布式为4p3,和砷位于同一周期,且未成对电子数也相同的元素,它们的外围电子排布式为:3d34s2、3d74s2,分别为钒、钴两种,
故答案为:4;4p3;2;
(2)在元素周期表中,同周期中从左向右,元素的非金属性增强,电负性增强,同主族元素从上向下,元素的非金属性减弱,电负性减弱,在元素周期表中,与 P紧邻的4种元素中电负性最大的是N.
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,Si、P、S元素处于同一周期且原子序数逐渐增大,P处于第VA族,所以第一电离能P>S>Si,
故答案为:N;P>S>Si;
(3)NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高,故沸点:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3;NH3分子间存在氢键,氨的沸点比同主族元素的氢物高,AsH3和PH3分子间不存在氢键,分子量大的氢化物分子间作用力大,沸点高;
(4)P4分子为正四面体构型,P4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,P原子采取sp3杂化.
相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水,
故答案为:sp3;P4和CS2是非极性分子,H2O是极性分子,根据相似相溶的原理,P4易溶于 CS2,难溶于水;
(5)GaxIn(1-x)As立方体形晶胞中每一个顶点和面心都有一个原子,晶胞内部有4个原子,晶胞含有总数为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,由化学式可知晶胞中As数目占原子总数的$\frac{1}{2}$,即晶胞中As原子数目为8×$\frac{1}{2}$=4,
故答案为:4;
(6)AIN晶胞中Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N原子数目为4,故晶胞质量m=$\frac{4(27+14)}{{N}_{A}}$,体积V=a3,密度$ρ=\frac{m}{V}$=$\frac{164}{{a}^{3}{N}_{A}}$.
故答案为:$\frac{164}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能及电负性、杂化方式判断、晶胞计算等,本题关键是结合化学式、均摊法计算晶胞中原子数目.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

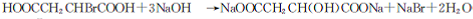 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
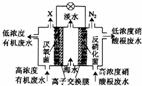 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )| A. | 中间室中的 Cl-向左室移动 | |
| B. | 左、右两室溶液混合后所得溶液的酸性:反应前<反应后 | |
| C. | X气体为CO2 | |
| D. | 左边离子交换膜为阴离子交換膜,右边离子交换膜为阳离子交換膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S>O>F | B. | S2->Cl->K+>Ca2+ | C. | F->O2->Na+>Mg2+ | D. | Fe>Fe2+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
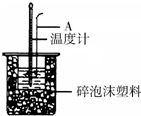 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com