
��15�֣����������ۡ�8��12���ش���ֱ�ը�¹ʣ���һ�����������ǶԻ�������Ĺ�ע��
��1��Ϊ�˼��ٿ�����SO2���ŷţ�����ȡ�Ĵ�ʩ�ǽ�úת��Ϊ�������ȼ�ϡ�
��֪��H2(g)��1/2O2(g)==H2O(g) ��H1����241.8 kJ��mol��1
C(s)��1/2O2(g)===CO(g) ��H2����110.5 kJ��mol��1
��̿��ˮ������Ӧ����CO���Ȼ�ѧ����ʽΪ�� ��
��2������CaC2�������ơ������ص������ܹ���ˮ��Ӧ���ֺ��Ԯ���������˺ܶ����ѡ������ʵ���ң��㴦���������Ż�ķ����� ��
��3���¹ʷ�����,��ը����������ը������¥�ܱ��Լ����ӵȴ����ܵ������ص��軯����Ⱦ������NaCN�ķ����ǣ���NaClO�ڼ��������¸�NaCN��Ӧ�������������ʣ���д���÷�Ӧ�����ӷ�Ӧ����ʽ ��
��4���绯ѧ���ⷨ����������ˮ�������ε���Ⱦ���绯ѧ����NO3-��ԭ����ͼ��ʾ����Դ����Ϊ ���a����b���������ܷ�ӦΪ4NO3-+4H+=5O2��+2N2��+2H2O����������ӦʽΪ ��

��5�������ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O72-ת��ΪCr(OH)3������ȥ����֪�ڳ����£�Ksp[Fe(OH)2]= 1��10��15��Ksp[Fe(OH)3]= 1��10��38 ��Ksp[Cr(OH)3]= 1��10��23 ��������Ũ����1��10��5mol/L����ʱ��Ϊ�������Ѿ���ȫ��������ش�
����ͬ�¶���Fe(OH)3���ܽ�� Cr(OH)3���ܽ�ȣ��>������<����=����
��Ũ��Ϊ0.1mol/L��Fe2+��10. 0mol/L Cr3+ͬʱ���ɳ�����pH��Χ�� ��
 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������H2SO4��Һ�м���100 mL 0.4 mol��L��1 Ba(OH)2��Һ���ų���������5.12 kJ�����������Ba(OH)2��Һ�м���100 mL 0.4 mol��L��1����ʱ���ų�������Ϊ2.2 kJ����Na2SO4��Һ��BaCl2��Һ��Ӧ���Ȼ�ѧ����ʽΪ
A��Ba2��(aq)��SO42��(aq)=BaSO4(s) ��H��+73 kJ��mol��1
C��Ba2��(aq)��SO42��(aq)=BaSO4(s) ��H����73 kJ��mol��1
B��Ba2��(aq)��SO42��(aq)=BaSO4(s) ��H��+18 kJ��mol��1
D��Ba2��(aq)��SO42��(aq)=BaSO4(s) ��H����18 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶�������ѡ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��������Һ�У���������һ���ܹ������������
A�����������Һ�Ժ�ɫ����Һ��Mg2+��Al3+��Br����SO42��
B�������£�c(H+)/c(OH��)��1010����Һ�У�Na+��NH4+��ClO����I��
C��0.1mol/LNaHCO3��Һ�У�K+��Ba2+��OH����Cl��
D���������۷ų�����H2����Һ�У�Fe2+��K+��Cl����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ�����и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A����0.1molFeCl3��Һ��1Lˮ�У�������Һ��Fe3+������ĿΪ0.1NA
B��1 mol���ǻ���1 mol������������������������Ϊ10NA
C�����¡���ѹ�£�4.6 g NO2��N2O4��������к��е���ԭ����ĿΪ0.2NA
D���ڸ����£���1 mol Fe��������ˮ������Ӧ��ת�Ƶ��ӵ���ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ�ɶ��и�����ѧ�����п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪K2Cr2O7��Һ�д�������ƽ�⣺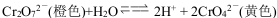 ��
��
����2mL 0.1mol��L K2Cr2O7��Һ�е���3��6mol/L NaOH��Һ����Һ�ɳ�ɫ��Ϊ��ɫ����������Һ���ٵ���5��ŨH2SO4����Һ�ɻ�ɫ��Ϊ��ɫ��
�����ữK2Cr2O7��Һ�е�������Na2SO3��Һ����Һ�ɳ�ɫ��Ϊ��ɫ��
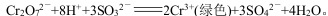
���з�����ȷ����
A��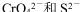 ��������Һ�пɴ�������
��������Һ�пɴ�������
B��ʵ���˵�������ԣ�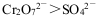
C��ϡ��K2Cr2O7��Һʱ����Һ�и�����Ũ�Ⱦ���С
D��ʵ��ٺ͢ھ���֤��K2Cr2O7��Һ�д�������ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����и�����ѧ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����л����˵����ȷ����
A�����ࡢ��֬��������һ�����ܷ���ˮ�ⷴӦ
B�������Cl2�ķ�Ӧ����ϩ��Br2�ķ�Ӧ����ͬһ���͵ķ�Ӧ
C��һ�������£�������1mol����1mol�ױ�������3molH2��Ӧ
D���Ҵ������������NaOHϡ��Һ��Ӧ����Ϊ�����о����й����š���OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�ĵ���У�߶���ѧ��10��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��a��b��c��d�ĸ������缫��GΪ�����ơ��йصķ�Ӧװ�ü����ַ�Ӧ�������£�
ʵ�� װ�� |
|
|
|
|
����ʵ������ | a��������Сb���������� | ��Һ�е�SO42-��b���ƶ� | d���ܽ�c����������� | ���Ӵ�d������ a�� |
�ɴ˿��ж������ֽ����Ļ��˳����
A.d>a>b>c B. a>b>c>d C. b>c>d>a D. a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
��ҵ�Ͽ������÷����е�CO2Ϊԭ����ȡ�״����䷴Ӧ����ʽΪ��CO2+3H2 CH3OH+H2O����ش��������⣺
CH3OH+H2O����ش��������⣺
��1����֪���³�ѹ�����з�Ӧ�������仯����ͼ��ʾ��

д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ__ ���÷�Ӧ�ġ�S____________0���>����<����=��������_______________����������ڸ÷�Ӧ�Է����С�
��2�����������Ӧ����ʽ��ƽ�ⳣ��Kֵ�����÷�Ӧ__ ��ѡ���ţ���
A��һ��������Ӧ�����ƶ�
B����ƽ���ƶ�ʱ����Ӧ������������С
C��һ�����淴Ӧ�����ƶ�
D����ƽ���ƶ�ʱ�淴Ӧ�����ȼ�С������
��3������Ӧ�������ݻ�Ϊ2��0L����Ӧʱ��4��0 min������������������������4.8g�������ʱ����CO2��ƽ����Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����и�����ѧ�ڷ�У������ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣�����Ϊ��ҵ�Ӻ�ˮ����ȡҺ�������ͼ��
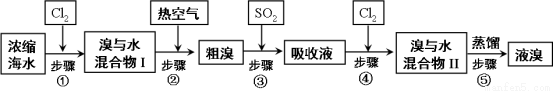
��֪����ķе�Ϊ59�棬����ˮ���ж��ԡ���ش�
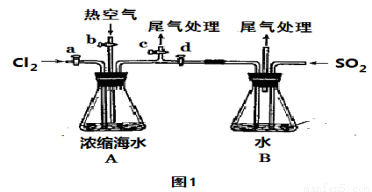
��1��ijͬѧ���á�ͼ1��װ�ý��в����������ܵ�ʵ�飬�����в����ʱ��Ӧ�رջ��� ������ ��
��2��������пɸ��� �����ж��ȿ���������
��3��������м��жϷ�Ӧ��ȫ�������� ��
��4���ӡ���ˮ����������ˮ������Ŀ���� ��
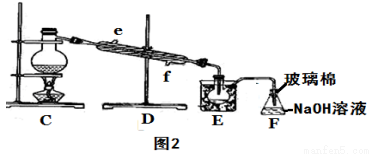
��5��������á�ͼ2��װ�ý�������������ƿ����δ��װ�¶ȼƣ���װ��λ��ʱӦע�� װ��C��ֱ�Ӽ��Ȳ�������Ӧ��Ϊ ������ʱ����ˮӦ�� �˽��루�e����f������ͼ��E��F�������� �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com