
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
分析 X、Y元素同周期,且电负性X>Y,则非金属性X>Y,结合元素周期律来解答.
解答 解:A.非金属性X>Y,若X为F、Y为O,则第一电离能:Y小于X;若X为O,Y为N,N的2p电子半满为稳定结构,则第一电离能:Y大于X,故A错误;
B.非金属性X>Y,态氢化物的稳定性:HmY小于HnX,故B正确;
C.非金属性X>Y,一般最高价含氧酸的酸性:X对应的酸性强于Y对应的,若X为F、O时不存在最高价含氧酸,故C错误;
D.非金属性X>Y,X和Y形成化合物时,X显负价,Y显正价,故D正确;
故选AC.
点评 本题考查元素的电负性与非金属性,为高频考点,把握非金属性的比较与电负性的关系为解答的关键,侧重分析与应用能力的考查,注意A中半满及C中可能不存在最高价含氧酸为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:推断题
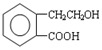
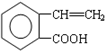
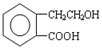 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.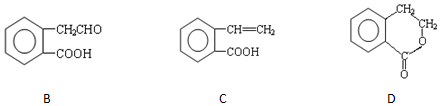
 +H2O
+H2O
 .
.

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时托盘上要垫上干净的称量纸 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
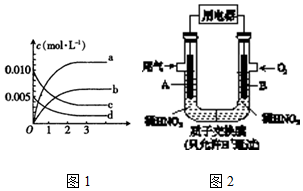
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
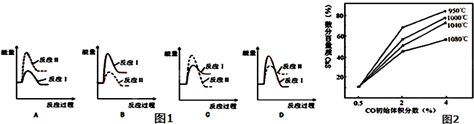
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
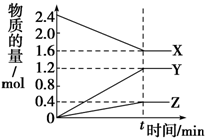 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com