
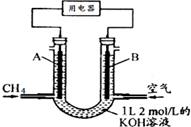
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
分析 燃料电池中,通入燃料的一端为原电池的负极,通入空气的一端为原电池的正极,n(KOH)=2mol/L×1L=2mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
解答 解:A、燃料电池中,通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极,OH-由移向负极,即从B端移向A端,故A错误;
B、当0<V≤22.4L时,0<n(CH4)≤1mol,则0<n(CO2)≤1mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故B错误;
C、当22.4 L<V≤44.8L,1mol<n(CH4)≤2mol,则1mol<n(CO2)≤2mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故C正确;
D、当V=33.6L时,n(CH4)=1.5mol,n(CO2)=1.5mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到0.5molK2CO3和1molKHCO3的溶液,则c(HCO3-)>c(CO32-)>c(OH-),故D错误.
故选C.
点评 本题考查了燃料电池的工作原理重要考点,计算要求的综合性较强,难度较大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸 | B. | 乙二酸 | C. | 丙酸 | D. | 丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molSi-O键的二氧化硅晶体中氧原子数为2NA | |
| B. | 标准状况下,含3NA个σ键的甲醛分子所占的体积约为22.4L | |
| C. | 2molNO和1molO2混合,在密闭容器中充分反应,容器内的分子数小于2NA | |
| D. | 1molFe与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com