
| 温度/℃ | 250 | 350 |
| K/(mol?L-2)-2 | 2.041 | x |
| A、0 | B、0.012 |
| C、32.081 | D、100 |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、放热185 kJ |
| B、吸热185 kJ |
| C、放热92.5 kJ |
| D、吸热92.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3 |
| B、NaOH |
| C、H2SO4 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定中和热时,应将NaOH溶液分次缓慢倒入装有盐酸的烧杯中,并搅拌 |
| B、配置溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| C、酸碱滴定时,若加入待测前用待测液润洗锥形瓶,将导致测定结果偏高 |
| D、检验某溶液是否含有SO42-时,应取少量溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子晶体中共价键越强,熔点越高 |
| B、金属元素和非金属元素形成的化合物一定是离子化合物 |
| C、含有阴离子的化合物一定含有阳离子 |
| D、分子晶体中分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+33.1kJ?mol-1 |
| B、+45.2kJ?mol-1 |
| C、-81.5kJ?mol-1 |
| D、-33.1kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌可以写溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应 |
| B、钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气 |
| C、铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜 |
| D、铜与浓硝酸可以制取NO2,常温下铁与浓耙酸也可以制取NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯化氢的电子式: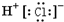 |
B、镁的原子结构示意图: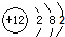 |
| C、乙酸的结构简式 C2H4O2 |
| D、碳酸钠的电离方程式 NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com