
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂.
(1)MgH2是一种离子化合物,其电子式为 .
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2 , 该反应的化学方程式为 .
(3)已知MgH2的有关热化学方程式如下: MgH2(s)Mg(s)+H2(g)△H1=+74.4 KJmol﹣1;
H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
Mg(s)+ ![]() O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1 .
O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1 .
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为 .
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为 . 
(4)炉膛内脱除SO2与NO的反应为2MgO(s)+2SO2 (g)+2NO(g)2MgSO4(s)+N2(g)△H=a KJmol﹣1 , 其平衡常数与温度的关系如图乙所示. ①上述反应的平衡常数表达式为K= .
②a(填“>”或“<”)0.
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2═Mg+2LiH.放电时,X极的电极反应式为 . 充电时,Y极的电极反应式为 .
【答案】
(1)[H:]﹣Mg2+[H:]﹣
(2)2Mg2Cu+3H2=MgCu2+3MgH2
(3)MgH2(s)+O2(g)=MgO(s)+H2O(g)△H=﹣309kJ?mol﹣1;T3<T2<T1
(4)![]() ?;<
?;<
(5)MgH2+2Li++2e﹣=Mg+2LiH;Li++e﹣=Li
【解析】解:(1)MgH2是一种离子化合物,镁失去最外层电子给氢原子,电子式为:[H:]﹣Mg2+[H:]﹣; 所以答案是:[H:]﹣Mg2+[H:]﹣;(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2 , 化学方程式为:2Mg2Cu+3H2=MgCu2+3MgH2;
所以答案是:2Mg2Cu+3H2=MgCu2+3MgH2;(3)①已知:ⅠMgH2(s)Mg(s)+H2(g)△H1=+74.4 KJmol﹣1;
ⅡH2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
ⅢMg(s)+ ![]() O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1
O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1
根据盖斯定律Ⅰ+Ⅱ+Ⅲ可得MgH2(s)+O2(g)=MgO(s)+H2O(g)△H=﹣309 kJmol﹣1;
所以答案是:MgH2(s)+O2(g)=MgO(s)+H2O(g)△H=﹣309 kJmol﹣1;②MgH2作贮氢材料时,单位贮氢材料释放出氢气,反应为MgH2(s)Mg(s)+H2(g)△H1=+74.4 KJmol﹣1 , 温度升高有利于氢气的释放,由图可知,T1、T2、T3氢气的释放速率减慢,则T3<T2<T1;
所以答案是:T3<T2<T1;(4)①反应2MgO(s)+2SO2 (g)+2NO(g)2MgSO4(s)+N2(g),化学平衡常数K= ![]() ;
;
所以答案是: ![]() ;②温度升高化学平衡向着吸热方向移动,由图可知温度升高,K减小,说明该反应为放热反应,则△H=a KJmol﹣1<0;
;②温度升高化学平衡向着吸热方向移动,由图可知温度升高,K减小,说明该反应为放热反应,则△H=a KJmol﹣1<0;
所以答案是:<;(5)全固态锂离子电池放电时电池反应为2Li+MgH2═Mg+2LiH,X极电极材料为MgH2 , 该极为正极,得电子,电极反应式为:MgH2+2Li++2e﹣=Mg+2LiH,则Y极为Li,作负极,电极反应式为:Li﹣e﹣=Li+ , ;充电时:Y极为阴极:反应式为:Li++e﹣=Li;
所以答案是:MgH2+2Li++2e﹣=Mg+2LiH;Li++e﹣=Li.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2OH3O++OH﹣ , 则液态NH3电离的方程式是
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= , 在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=
(3)25℃时,0.1mol/L的HA溶液中 ![]() =1010 . 请回答下列问题:
=1010 . 请回答下列问题:
①HA是(填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是(填字母)
A.c(HA) B. ![]() C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3 , 则三种关系为(用“V1、V2、V3”和“>、<、=”表示).
(5)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 . (填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是 , 反应所用时间长短关系是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【改编题】当你走进化学实验室时,首先要认真阅读并遵守《实验室安全守则》。以下实验室中的学生行为不符合实验室安全规范的是(回答两条即可):

(1)_____________________________________________________
(2)_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6 , 与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.
(1)B元素在周期表中的位置;D元素基态原子电子排布式为 .
(2)E的气态氢化物在同族元素中沸点最高的原因是: .
(3)A、C两元素第一电离能> . (填元素符号)
(4)B元素能形成多种配合物.元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是的原子.
(5)A元素可与氢元素形成离子化合物,电子式为;这种离子化合物可与水反应,化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐晶体是由钠离子和氯离子组成的,且均为等距离的交错排列,如图所示。已知食盐的密度是2.2 g/cm3,阿伏加德罗常数为6.02×1023/mol。在食盐晶体中两个距离最近的钠离子间的距离最接近于 厘米(保留整数)。
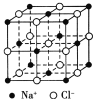
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L
B.13.5 L
C.15.7 L
D.16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们可以将SiO2的晶体结构想象为在晶体硅的Si—Si键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )
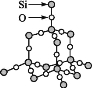
A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用
B.每个O原子也通过Si—O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故能叫分子式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com