
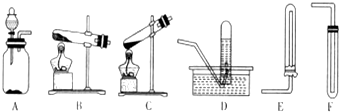
分析 (1)实验室用氯化铵与氢氧化钙加热制备氨气,依据反应物状态和反应条件确定发生装置;
(2)过氧化氢与Mn02混合制氧气,为固体与液体不加热,据此选择发生装置.
解答 解:(1)实验室用氯化铵与氢氧化钙加热制备氨气,为固体+固体加热,选择仪器BE;反应的方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:BE;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)过氧化氢与Mn02混合制氧气,为固体+液体不加热,选择AD;
故答案为:AD.
点评 本题考查了气体发生装置的选择,明确反应物状态和反应条件是选择的依据,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NH3的水溶液能导电,说明NH3是电解质 | |
| C. | SO2能使溴水褪色,表现了漂白性 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 汽车尾气-------光化学污染-------咳嗽和气喘者增多 | |
| B. | 含磷洗衣粉--------水体富营养化--------水栖生物大量死亡 | |
| C. | 人口增多--------空气中CO2浓度增大--------温室效应 | |
| D. | 氟氯烃--------臭氧空洞--------皮肤癌患者增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com