
在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()

A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
考点: 化学反应速率与化学平衡图象的综合应用;体积百分含量随温度、压强变化曲线.
专题: 化学平衡专题.
分析: 该反应是一个反应前后气体体积不变的放热反应,增大压强和使用催化剂只增大反应速率但不影响平衡移动,升高温度增大反应速率,平衡向逆反应方向移动,据此分析解答.
解答: 解:A.该反应是一个反应前后气体体积不变的放热反应,增大压强能增大反应速率但不影响平衡移动,故A错误;
B.加入催化剂和增大压强都增大反应速率且不影响平衡移动,故B错误;
C.增大压强平衡不移动,所以生成物的含量不变,故C错误;
D.升高温度,反应速率增大,缩短反应到达平衡的时间,平衡向逆反应方向移动,生成物的含量减小,故D正确;
故选:D.
点评: 本题考查了图象分析,根据可逆反应特点来分析解答即可,对应该反应来说,压强和催化剂都不改变平衡移动,为易错点.


科目:高中化学 来源: 题型:
(1)0.25molH3PO4分子中含有氢原子的物质的量是 ,含有氧原子数目为 .
(2)0.3molH2O与0.4molCO2的物质的量之比为 ,所含分子数目之比为 ,所含氧原子数目之比为 .
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl﹣,则ACl2的摩尔质量是 ,A的相对原子质量是 ,ACl2的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C均为短周期元素,A、B两种元素的原子具有相同数目的电子层,A元素原子最外层电子数是B元素原子最外层电子数的两倍,A元素原子M层电子数为K层电子数的3倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍.请完成下列空白:
(1)A元素为 ,C元素为 ,B元素的名称为 .
(2)A位于元素周期表中第 周期第 族
(3)C的离子结构示意图为
(4)A、B、C三种元素形成的原子半径由大到小的顺序是 (化学符号)
(5)A、B、C三种元素最高价氧化物对应的水化物中分别为 、 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
反应X(g)+Y(g)⇌2Z(g);△H<0,达到平衡时,下列说法正确的是()
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学平衡移动的分析中,不正确的是()
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A. ①④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:mA(g)+nB(g)⇌xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是()
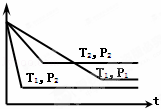
A. T1>T2,P1>P2,m+n>x,正反应放热
B. T1<T2,P1<P2,m+n<x,正反应吸热
C. T1>T2,P1<P2,m+n<x,正反应放热
D. T1<T2,P1>P2,m+n>x,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是()
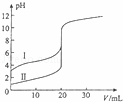
A. Ⅱ表示的是滴定醋酸的曲线
B. PH=7时,滴定醋酸消耗V(NaOH)小于20ml
C. V(NaOH)=20ml时,C(Cl﹣)=C(CH3COO﹣)
D. V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO﹣ )>C(H+)>C(OH﹣ )
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Zn(s)+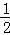 O2(g)═ZnO(s)△H=﹣350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为()
O2(g)═ZnO(s)△H=﹣350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为()
A. 5.4 kJ B. 350 kJ C. 3.5 kJ D. 8.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com