
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
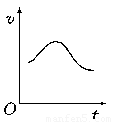
(1)反应开始进行时,反应速率加快的原因是(要求写出化学方程式)
;
(2)反应后期,反应速率下降的原因是
。
(1)2KCl O3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,溶液中c(H+)增大,化学反应速率加快。
(2)随着反应的进行,KClO3和NaHSO3浓度明显减小,后期化学反应速率减慢。
【解析】
试题分析:(1)反应起始阶段,根据反应的化学方程式2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4可知,溶液中c(H+)逐渐增大,所以化学反应速率加快。
(2)随着反应的进行,KClO3和NaHSO3浓度明显减小,即反应物的浓度降低,从而导致后期化学反应速率减慢。
考点:考查外界条件对反应速率的影响
点评:该题是高考中的常见题型,试题基础性强,侧重对稀释能力的考查,属于中等难度的试题。该题有利于培养学生的灵活应变能力,也有利于培养学生的知识迁移能力。


科目:高中化学 来源: 题型:

(1)反应开始时,反应速率加快的原因是_____________________________________________。
(2)反应后期,反应速率又下降的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)写出该反应的离子方程式____________________________;
(2)为什么反应开始时速率加快____________________________;
为什么后期反应速率下降____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)反应开始反应速率加快的原因是________________________________________。
(2)反应后期反应速率下降的原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

图9-4?
(1)为什么反应开始一段时间内速率逐渐加快? 。?
(2)为什么后期反应速率逐渐减慢? 。?
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-![]() Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
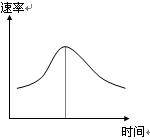
(1)反应开始时反应速率加快的原因是 ![]() ;
;
(2)反应后期反应速率下降的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com