
【题目】研究非元素及其化合物的性质具有重要意义。
Ⅰ. 含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测定烟气中SO2的体积分数。
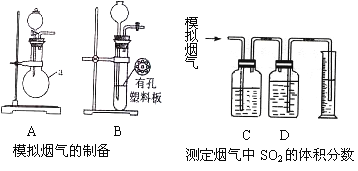
(一)模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为___________________________。
(2)用B装置制CO2,使用该装置优点的是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
(二)测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是__________、__________。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液 ④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数____________________。
Ⅱ.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。

(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
实验操作 | 现 象 | 结 论 |
氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。
②请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。
【答案】 Na2SO3+H2SO4(浓)= Na2SO4+H2O+SO2↑ 可以随时控制反应的发生和停止 ① ④ ![]() % 不合理 制取的氯气中含有氯化氢,溶于水遇碳酸氢钠粉末有气泡 浓盐酸 MnO2 硫化钠溶液 ab c 双手紧握(或微热)试管丁
% 不合理 制取的氯气中含有氯化氢,溶于水遇碳酸氢钠粉末有气泡 浓盐酸 MnO2 硫化钠溶液 ab c 双手紧握(或微热)试管丁
【解析】试题分析:Ⅰ.(1)装置A没有加热,这说明所用试剂是浓硫酸和亚硫酸钠。
(2)B装置制CO2,属于简易启普发生器。
(4)二氧化硫具有强的还原性,可以用强氧化性的高锰酸钾吸收;二氧化碳在饱和碳酸氢钠溶液中的溶解度很小,可以用排饱和碳酸氢钠溶液来侧量其体积;
(5)气体总体积是![]() ,二氧化碳的体积是Vml;
,二氧化碳的体积是Vml;
Ⅱ. (1) ①A装置用浓盐酸与二氧化锰加热制取氯气,氯气中含有氯化氢气体。
② 根据还原剂的还原性大于还原产物的还原性验证Cl-和S2-的还原性强弱;
(2)根据气体受热体积膨胀及二氧化氮与水反应导致气体体积减小分析;
解析:Ⅰ. (1)装置A没有加热,这说明所用试剂是浓硫酸和亚硫酸钠,反应方程式是Na2SO3+H2SO4(浓)= Na2SO4+H2O+SO2↑。
(2)B装置制CO2,属于简易启普发生器,可以随时控制反应的发生和停止;(4)二氧化硫具有强的还原性,可以用强氧化性的高锰酸钾吸收;二氧化碳在饱和碳酸氢钠溶液中的溶解度很小,可以用排饱和碳酸氢钠溶液来测量其体积,所以C、D中盛有的药品分别是①KMnO4溶液、 ④饱和NaHCO3溶液;(5)气体总体积是at1,二氧化碳的体积是Vml, 二氧化碳的体积分数是![]() ,二氧化硫的体积分数是
,二氧化硫的体积分数是![]() =
=![]() ;
;
Ⅱ. (1) ①A装置用浓盐酸与二氧化锰加热制取氯气,氯气中含有氯化氢气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡,所以实验结论不合理。
②还原剂的还原性大于还原产物的还原性,根据反应![]() 验证 Cl-和S2-的还原性强弱,所以甲、乙、丙中盛放的试剂是甲浓盐酸、 乙是MnO2、 丙是硫化钠溶液。
验证 Cl-和S2-的还原性强弱,所以甲、乙、丙中盛放的试剂是甲浓盐酸、 乙是MnO2、 丙是硫化钠溶液。
(2)根据以上分析,先关闭止水夹ab,再打开止水夹c,使烧杯中的水进入试管丁的操作是:双手紧握(或微热)试管丁,试管中气体受热体积膨胀,气体逸出,NO2与水接触后发生反应![]() ,气体体积减小,则烧杯中的水进入试管丁。
,气体体积减小,则烧杯中的水进入试管丁。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+2H2(g)![]() CH3OH(g)ΔH=Q kJ·mol1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
CH3OH(g)ΔH=Q kJ·mol1;在三个不同容积的容器中分别充入1 mol CO与2 mol H2,恒温恒容,测得平衡时CO的转化率如下表。下列说法正确的是
温度(℃) | 容器体积 | CO转化率 | 平衡压强(p) | |
① | 200 | V1 | 50% | p1 |
② | 200 | V2 | 70% | p2 |
③ | 350 | V3 | 50% | p3 |
A.反应速率:③>①>②
B.平衡时体系压强:p1∶p2=5∶4
C.若容器体积V1>V3,则Q<0
D.若实验②中CO和H2用量均加倍,则CO转化率<70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由前18号元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
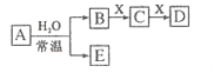
A. 若D为白色沉淀,与A摩尔质量相等,则X一定是含铝元素的盐
B. 若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其阳离子与阴离子比为2:1
D. 若X是Na2CO3,C为CO2分子,则A一定是氯气,且D和E不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置.
如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
(1)氢氧燃料电池的能量转化的主要形式是由 , 在导线中电子流动方向为(用a、b表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因是 .
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ2Li+H2 ![]() 2LiH
2LiH
ⅡLiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是 , 反应Ⅱ中的氧化剂是 . (均填化学式)
②已知LiH固体密度为0.82g/cm3 , 用锂吸收224L(标准状况)H2 , 则被吸收的H2体积与生成的LiH体积比为 .
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化率随时间变化的关系曲线(Yt)如下图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化率随时间变化的关系曲线(Yt)如下图所示。下列说法正确的是
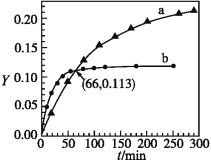
A.b代表0 ℃下CH3COCH3的Yt曲线
B.反应进行到20 min末,CH3COCH3的![]() >1
>1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的![]() =1
=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Fe3+ C.Fe2+、NH4+ D.Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚刚从农业学院毕业的小刘,准备利用所学的知识在农村搞无土栽培。他配制的培养液中含有Mg2+、K+、Ca2+、Zn2+,其浓度都是0.1molL﹣1,培养一段时间后,培养液中剩余最多的是( )
A. Ca2+ B. Zn2+ C. Mg2+ D. K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于物理变化的是( )
A. 银白色的钠露置在空气中表面变暗B. 蛋白质溶液中加入饱和硫酸铵溶液
C. 蓝色硫酸铜固体中加入浓硫酸D. 石墨在一定条件下转化成金刚石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com