
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,Cu和稀硝酸反应生成硝酸铜、NO和水,二者恰好完全反应,
(1)根据转移电子守恒计算NO体积;
(2)根据N原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NO),再根据c=$\frac{n}{V}$计算c(HNO3).
解答 解:n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,Cu和稀硝酸反应生成硝酸铜、NO和水,二者恰好完全反应,
(1)根据转移电子守恒得V(NO)=$\frac{0.3mol×2}{(5-2)}×22.4L/mol$=4.48L,
答:在标况下生成NO体积为4.48L;
(2)根据N、Cu原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NO)=2n(Cu)+n(NO)=2×0.3mol+$\frac{0.3mol×2}{5-2}$=0.8mol,c(HNO3)=$\frac{n}{V}$=$\frac{0.8mol}{0.4L}$=2mol/L,
答:原硝酸的物质的量的浓度是2mol/L.
点评 本题考查氧化还原反应计算,为高频考点,明确反应中转移电子守恒、原子守恒是解本题关键,注意守恒法在计算中的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
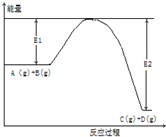 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
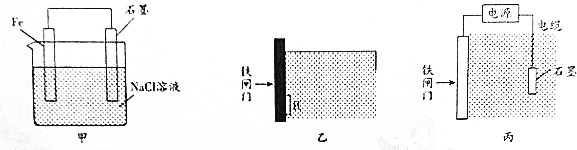
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Mg2+,Cl-,OH- | B. | Na+,Cu2+,CO32-,NO3- | ||
| C. | H+,Na+,CO32-,Cl- | D. | Na+,Mg2+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mo1K0H的溶液与1mo1CO2完全反应后,溶液中c(K+)>c(HCO3- ) | |
| B. | 0.2mo1/LCH3COOH溶液与0.1mo1/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 将100mL0.1mo1.L-1的醋酸稀释至pH=4:n(CH3COO-)+n(CH3COOH)=0.01mo1 | |
| D. | pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
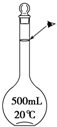 实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:
图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com