6.3克镁铝合金在600ml 1mol/L的盐酸中恰好完全溶解,若要使生成的沉淀最多,求
(1)至少需加入2mol/L NaOH的体积是多少?
(2)合金中镁 铝的质量各多少?
解:6.3克镁铝合金在600ml 1mol/L的盐酸中恰好完全溶解,若要使生成的沉淀最多,镁离子、铝离子转化为氢氧化镁、氢氧化铝沉淀,反应后溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=n(NaOH)=0.6L×1mol/L=0.6mol,
(1)根据钠离子守恒n(NaOH)=n(NaCl)=0.6mol,故需要氢氧化钠溶液的体积=
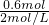
=0.3L=300mL,
答:需要氢氧化钠溶液的体积为300mL;
(2)令镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒,则:
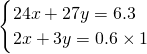
,解得x=0.15,y=0.1,
故混合物中,Mg的质量为0.15mol×24g/mol=3.6g,Al的质量为0.1mol×27g/mol=2.7g,
答:混合物中,Mg的质量为3.6g,Al的质量为2.7g.
分析:6.3克镁铝合金在600ml 1mol/L的盐酸中恰好完全溶解,若要使生成的沉淀最多,镁离子、铝离子转化为氢氧化镁、氢氧化铝沉淀,反应后溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=n(NaOH)=0.6L×1mol/L=0.6mol,
(1)根据钠离子守恒n(NaOH)=n(NaCl),再根据V=
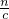
计算需要氢氧化钠溶液的体积;
(2)令镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算x、y的值,再根据m=nM计算各自的质量.
点评:本题考查混合物的有关计算,比较基础,清楚发生的反应是关键,注意守恒思想的运用,可以根据方程式进行计算,但比较繁琐.

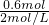 =0.3L=300mL,
=0.3L=300mL,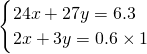 ,解得x=0.15,y=0.1,
,解得x=0.15,y=0.1,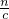 计算需要氢氧化钠溶液的体积;
计算需要氢氧化钠溶液的体积;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案